题目内容
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4.下列说法正确的是( )
| A、Cu2S既是氧化产物又是还原产物 |
| B、5 mol FeS2发生反应,有14mol电子转移 |
| C、产物中的SO42-有一部分是氧化产物 |
| D、FeS2只作还原剂 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价,以此来解答.
解答:
解:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价,A.Cu2S只是还原产物,故A错误;
B.5 mol FeS2发生反应,由S元素的化合价升高可知,有3mol×[6-(-1)]=21mol e-转移,故B错误;
C.S元素的化合价既升高又降低,由硫酸根离子守恒可知,17个硫酸根离子中有3个SO42-是氧化产物,故C正确;
D.CuSO4是氧化剂,FeS2既是还原剂又是还原剂,故D错误;
故选C.
B.5 mol FeS2发生反应,由S元素的化合价升高可知,有3mol×[6-(-1)]=21mol e-转移,故B错误;
C.S元素的化合价既升高又降低,由硫酸根离子守恒可知,17个硫酸根离子中有3个SO42-是氧化产物,故C正确;
D.CuSO4是氧化剂,FeS2既是还原剂又是还原剂,故D错误;
故选C.
点评:本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,注意5 mol FeS2发生反应时只有3molS失去电子,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
我国劳动人民在3000多年前就制造出精美的青铜器,青铜是铜锡合金,具有良好的可铸造性.耐磨性和耐腐蚀性.取青铜样品8.1g,经分析其中含锡0.9g,此青铜中铜与锡的质量比是( )
| A、9:2 | B、9:1 |
| C、8:1 | D、4:1 |
分析如下残缺的反应:RO3-+ +6H+=3R2↑+3H2O.下列叙述正确的是( )
| A、上式中缺项所填物质在反应中作氧化剂 | ||
| B、R的原子半径在同周期元素原子中最小 | ||
| C、R一定是周期表中的第VA族元素 | ||
D、RO
|
如图表代表周期表中的几种短周期元素,下列说法中错误的是( )
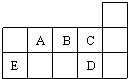

| A、A、B、C第一电离能的大小顺序为C>B>A |
| B、C、D气态氢化物稳定性强弱和沸点高低均为C>D |
| C、AD3和ED4两分子的中心原子均为sp3杂化 |
| D、ED4分子中各原子均达8电子结构 |
有关纯碱和小苏打的叙述正确的是( )
| A、等质量的Na2CO3、NaHCO3分别与足量的稀盐酸反应,NaHCO3产生的CO2多 |
| B、等质量的Na2CO3、NaHCO3分别与足量的同浓度盐酸反应,NaHCO3消耗的盐酸多 |
| C、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 |
| D、Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应 |
将植物油和水分离的方法是( )
| A、过滤 | B、蒸馏 | C、分液 | D、萃取 |
下列说法中正确的是( )
| A、油脂、淀粉、蛋白质均为可水解的高分子化合物. | ||||
B、日本福岛核电站爆炸时释放的两种放射性核素
| ||||
| C、硅酸凝胶、氯化钠注射液属于胶体. | ||||
| D、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |