题目内容
写出表示下列变化的有关反应化学方程式,并计算如果要制取635g漂白粉,一共需要含杂质4%的石灰石多少克?
石灰石→生石灰→消石灰→漂白粉.
石灰石→生石灰→消石灰→漂白粉.
考点:有关混合物反应的计算
专题:计算题
分析:依次发生反应:CaCO3
CaO+CO2↑,CaO+H2O═Ca (OH)2,2Cl2+2Ca (OH)2═CaCl2+Ca(ClO)2+2H2O,可知存在关系式:2 CaCO3~Ca(ClO)2+CaCl2计算需要碳酸钙的质量.
| ||
解答:
解:石灰石→生石灰→消石灰→漂白粉转化中依次发生化学方程式:①CaCO3
CaO+CO2↑,②CaO+H2O═Ca (OH)2,③2Cl2+2Ca (OH)2═CaCl2+Ca(ClO)2+2H2O;
假设需要石灰石的质量为mg,则:
2 CaCO3~Ca(ClO)2+CaCl2
200 254
mg×(1-4%) 635g
200:254=mg×(1-4%):635g
解得m=520.8
答:依次发生反应:CaCO3
CaO+CO2↑,CaO+H2O═Ca (OH)2,2Cl2+2Ca (OH)2═CaCl2+Ca(ClO)2+2H2O;需要含杂质4%的石灰石520.8g.
| ||
假设需要石灰石的质量为mg,则:
2 CaCO3~Ca(ClO)2+CaCl2
200 254
mg×(1-4%) 635g
200:254=mg×(1-4%):635g
解得m=520.8
答:依次发生反应:CaCO3
| ||
点评:本题考查化学方程式书写、多步反应有关计算,难度中等,注意多步反应利用关系式计算.

练习册系列答案
相关题目
随着人们生活水平的不断提高,环保意识的增强,下列做法不科学的是( )
| A、购物时自带环保购物袋或竹篮 |
| B、大力发展清洁能源,如太阳能、氢能、风能等等 |
| C、出门尽量步行或者乘坐公交车,少开私家车 |
| D、随意丢弃废旧电池 |
下列叙述中,正确的是( )
| A、如果加四氯化碳呈现紫色,证明原溶液中存在I- |
| B、加入盐酸产生白色沉淀的溶液一定是硝酸银溶液 |
| C、二氧化硅是酸性氧化物,能够与水反应生成酸 |
| D、氢氟酸是弱酸,但会腐蚀玻璃 |
在标准状况下,将CO2和CO的混合气体(密度是H2的16倍)充满一盛有足量Na2O2的 密闭容器中(容积为22.4L),用间断的电火花引发至充分反应.反应完全后容器里的存在物叙述正确的是 ( )
| A、存在0.5 mol的CO |
| B、存在0.125 mol的O2 |
| C、存在0.25 mol的Na2CO3 |
| D、存在1.25 mol的Na2CO3 |
0.1moL的某羧酸完全燃烧时,产生二氧化碳和水共3.4mol,该羧酸是( )
| A、C15H27COOH |
| B、C15H31COOH |
| C、C17H31COOH |
| D、C17H33COOH |
我国劳动人民在3000多年前就制造出精美的青铜器,青铜是铜锡合金,具有良好的可铸造性.耐磨性和耐腐蚀性.取青铜样品8.1g,经分析其中含锡0.9g,此青铜中铜与锡的质量比是( )
| A、9:2 | B、9:1 |
| C、8:1 | D、4:1 |
如图表代表周期表中的几种短周期元素,下列说法中错误的是( )
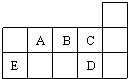

| A、A、B、C第一电离能的大小顺序为C>B>A |
| B、C、D气态氢化物稳定性强弱和沸点高低均为C>D |
| C、AD3和ED4两分子的中心原子均为sp3杂化 |
| D、ED4分子中各原子均达8电子结构 |
实验室配制250mL 0.2mol?L-1的Na2CO3溶液,必需用到的仪器是( )
A、 锥形瓶 |
B、 试管 |
C、 酒精灯 |
D、 容量瓶 |