题目内容
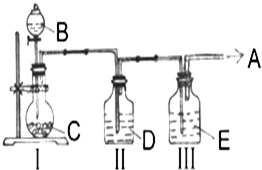 实验室中制取少量干燥纯净的气体A,可用如图装置
实验室中制取少量干燥纯净的气体A,可用如图装置说明:Ⅰ中的漏斗为分液漏斗,转动活塞可以控制液体滴加的速率
(1)若A可以灭火,则A物质是
(2)若C物质是淡黄色粉末,则不需要Ⅲ装置,A物质是
考点:常见气体制备原理及装置选择,气体的净化和干燥
专题:实验题
分析:(1)常用于灭火的气体为二氧化碳,实验室中一般使用稀盐酸与碳酸钙反应制取二氧化碳;氯化氢具有挥发性,必须将二氧化碳中的氯化氢利用饱和碳酸氢钠除去;然后用浓硫酸干燥二氧化碳,据此进行解答;
(2)淡黄色粉末为过氧化钠,B中液体为水,过氧化钠与水反应生成氢氧化钠和氧气,然后使用浓硫酸干燥即可.
(2)淡黄色粉末为过氧化钠,B中液体为水,过氧化钠与水反应生成氢氧化钠和氧气,然后使用浓硫酸干燥即可.
解答:
解:(1)若A可以灭火,则A为CO2,通常使用碳酸钙与盐酸反应制取二氧化碳,盐酸具有挥发性,制取的二氧化碳中混有氯化氢气体,应该使用饱和NaHCO3溶液除去二氧化碳中的杂质HCl,然后使用浓H2SO4干燥,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;
故答案为:CO2;饱和NaHCO3溶液;除HCl;浓H2SO4;CaCO3+2H+=Ca2++CO2↑+H2O;
②C物质是淡黄色粉末,则B中分液漏斗中盛放的为水,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑.
故答案为:O2;H2O;2Na2O2+2H2O=4Na++4OH-+O2↑.
故答案为:CO2;饱和NaHCO3溶液;除HCl;浓H2SO4;CaCO3+2H+=Ca2++CO2↑+H2O;
②C物质是淡黄色粉末,则B中分液漏斗中盛放的为水,过氧化钠与水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑.
故答案为:O2;H2O;2Na2O2+2H2O=4Na++4OH-+O2↑.
点评:本题考查了常见气体的制备原理,题目难度不大,注意掌握常见的气体制备方法及装置选择方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
随着人们生活水平的不断提高,环保意识的增强,下列做法不科学的是( )
| A、购物时自带环保购物袋或竹篮 |
| B、大力发展清洁能源,如太阳能、氢能、风能等等 |
| C、出门尽量步行或者乘坐公交车,少开私家车 |
| D、随意丢弃废旧电池 |
能正确表示下列反应的离子反应方程式为( )
| A、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| B、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| C、大理石溶于醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、向明矾(KAl(SO4)2?12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
下列叙述中,正确的是( )
| A、如果加四氯化碳呈现紫色,证明原溶液中存在I- |
| B、加入盐酸产生白色沉淀的溶液一定是硝酸银溶液 |
| C、二氧化硅是酸性氧化物,能够与水反应生成酸 |
| D、氢氟酸是弱酸,但会腐蚀玻璃 |
在标准状况下,将CO2和CO的混合气体(密度是H2的16倍)充满一盛有足量Na2O2的 密闭容器中(容积为22.4L),用间断的电火花引发至充分反应.反应完全后容器里的存在物叙述正确的是 ( )
| A、存在0.5 mol的CO |
| B、存在0.125 mol的O2 |
| C、存在0.25 mol的Na2CO3 |
| D、存在1.25 mol的Na2CO3 |
如图表代表周期表中的几种短周期元素,下列说法中错误的是( )


| A、A、B、C第一电离能的大小顺序为C>B>A |
| B、C、D气态氢化物稳定性强弱和沸点高低均为C>D |
| C、AD3和ED4两分子的中心原子均为sp3杂化 |
| D、ED4分子中各原子均达8电子结构 |