题目内容
(1)在下列物质中:①CO2 ②KOH ③He ④BaSO4 ⑤NaCl.其中只含有离子键的是(填序号,下同) ,既含有离子键又含有共价键的是 ,不含化学键的是 .
(2)下列物质在所述变化中:①烧碱熔化 ②HCl气体溶于水 ③NH4Cl受热分解 ④干冰升华.其中化学键未被破坏的是(填序号,下同) ,仅发生共价键破坏的是 ,既发生离子键破坏,又发生共价键破坏的是 .
(2)下列物质在所述变化中:①烧碱熔化 ②HCl气体溶于水 ③NH4Cl受热分解 ④干冰升华.其中化学键未被破坏的是(填序号,下同)
考点:共价键的形成及共价键的主要类型,离子化合物的结构特征与性质,不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:(1)一般来说,金属元素与非金属元素之间形成离子键,同种非金属元素之间形成非极性键,不同非金属元素之间形成极性键,以此判断;
(2)化学变化中一定有化学键断裂和生成,离子化合物的熔化、共价键化合物的电离均存在化学键的断裂;而升华只破坏分子间作用力,不破坏化学键,以此来解答.
(2)化学变化中一定有化学键断裂和生成,离子化合物的熔化、共价键化合物的电离均存在化学键的断裂;而升华只破坏分子间作用力,不破坏化学键,以此来解答.
解答:
解:(1)①CO2中含C、O之间的共价键,②KOH中含离子键和H-O共价键,③He中不存在化学键,④BaSO4中离子键和S-O共价键,⑤NaCl中只含离子键,
故答案为:⑤;②④;③;
(2)①烧碱熔化,只破坏离子键,②HCl气体溶于水只破坏共价键,而③NH4Cl受热分解既发生离子键破坏,又发生共价键破坏,④干冰升华不破坏化学键,
故答案为:④;②;③.
故答案为:⑤;②④;③;
(2)①烧碱熔化,只破坏离子键,②HCl气体溶于水只破坏共价键,而③NH4Cl受热分解既发生离子键破坏,又发生共价键破坏,④干冰升华不破坏化学键,
故答案为:④;②;③.
点评:本题考查物质中的化学键及变化过程中化学键的变化,为高频考点,把握化学键形成的一般规律为解答的关键,注意稀有气体中不存在化学键及升华破坏分子间作用力而不破坏化学键,注重基础知识的考查,题目难度不大.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
 在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)═2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )
在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g)═2HBr(g)△H<0.当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法正确的是( )| A、若b、c点的平衡常数分别为K1、K2,则K1>K2 |
| B、a、b两点的反应速率:b>a |
| C、为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法 |
| D、若平衡后保持温度不变,压缩容器体积平衡一定不移动 |
下列有关说法正确的是( )
| A、在多电子的原子里,能量高的电子通常在离核近的区域内运动 |
| B、最外层电子数为8的微粒均是稀有气体元素的原子 |
| C、俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
| D、在周期表中金属和非金属的分界线附近寻找制备半导体材料 |
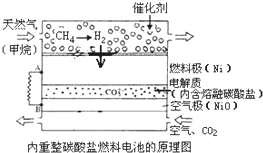 以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )
以熔融Li2CO3和K2CO3为电解质,天然气经内重整催化作用提供反应气的燃料电池如图,下列说法不正确的是( )| A、外电路电子流动方向:由A流向B |
| B、空气极发生反应的离子方程式是O2+4e-=2O2- |
| C、以此燃料电池为电源电解精炼铜,当电路有0.6mol e?转移,有19.2g精铜析出 |
| D、负极反应为H2-2e-+CO32-=CO2+H2O |
下列离子方程式正确的是( )
| A、硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ |
| B、金属钾与水反应:K+2H2O═K++2OH-+H2↑ |
| C、碳酸氢钙溶液中加入少量氢氧化钠溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O═2HClO+CaSO3↓ |
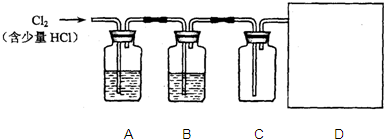
 试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.
试管B中的试剂为澄清石灰水.向试管A中滴入盐酸.
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: