题目内容
13.同温同压时,含相同分子数的H2O和NH3一定具有相同的( )| A. | 体积 | B. | 原子个数 | C. | 质量 | D. | 电子数 |
分析 同温同压下,气体摩尔体积相等,根据N=nNA、m=nM进行有关计算,注意水分子与氨气分子的结构特点:水分子为3原子分子,含有10个电子;氨气分子为4原子分子,含有10个电子.
解答 解:A.如果水是液体时,气体摩尔体积对其不适用,虽然二者物质的量相等,但其体积不等,故A错误;
B.水分子为3原子分子,氨气分子为4原子分子,含相同分子数的H2O和NH3,原子个数之比为:3:4,故B错误;
C.依据N=nNA、m=nM,含相同分子数的H2O和NH3物质的量相等,质量之比为18:17,故C错误;
D.1个氨气分子和1个水分子都含有10个电子,则含相同分子数的H2O和NH3一定具有相同的电子数,故D正确;
故选:D.
点评 本题考查了物质的量的有关计算,灵活运用物质的量有关公式解答即可,注意气体摩尔体积的适用范围及适用条件,易错选项是A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列关于Na2O2的说法中,错误的一项是( )
| A. | 钠与氧气直接反应不能得到Na2O2 | |
| B. | Na2O2遇水剧烈反应放出O2,且每生成1 mol O2转移2 mol电子 | |
| C. | Na2O2与CO2可以反应放出O2,因此可以用作潜水艇的供氧剂 | |
| D. | Na2O2在空气中长时间暴露最后会生成Na2CO3 |
4.下列离子方程式中正确的是( )
| A. | NH4HCO3溶液与过量KOH浓溶液:NH4++OH-═NH3↑+H2O | |
| B. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
1.一定浓度的醋酸溶液,在下列溶剂中电离程度最大的是( )
| A. | H2O | B. | 液NH3 | C. | 液态HF | D. | 纯H2SO4 |
18.下列说法正确的是( )
| A. | 分子中含有两个氢原子的酸一定是二元酸 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | Na2O、Na2O2组成元素相同,与CO2反应产物相同 | |
| D. | 钢铁发生电化学腐蚀时,负极的电极反应式为Fe-3e-═Fe3+ |
5.下列各组物质中,化学键类型完全相同的是( )
| A. | SO2和NaOH | B. | CO2和H2O | C. | Cl2和HCl | D. | CCl4和NaCl |
2.设NA代表阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,100 mL 1 mol•L-1 Na2CO3溶液中含有的阴离子数大于0.1NA | |
| B. | 常温常压下,28g14CO和N2的混合物所含的质子数为14NA | |
| C. | 将NA个NH3分子溶于1L水中得到1 mol•L-1的氨水 | |
| D. | 1molCl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA |
3.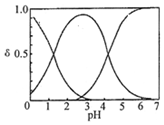 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A. | 0.1mol•L-1H2C2O4溶液使KMnO4溶液褪色的离子方程式:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 0.1 mol•L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |