题目内容
1.一定浓度的醋酸溶液,在下列溶剂中电离程度最大的是( )| A. | H2O | B. | 液NH3 | C. | 液态HF | D. | 纯H2SO4 |
分析 醋酸电离出醋酸根离子和氢离子,电离方程式为CH3COOH?CH3COO-+H+,根据影响电离平衡的因素判断.
解答 解:A.加水稀释促进醋酸的电离,CH3COOH?CH3COO-+H+,向正方向移动,但是移动程度较小;
B.加液NH3,NH3会与H+反应,CH3COOH?CH3COO-+H+,向正方向移动,移动程度比A大;
C.加液态HF,HF电离的H+,会抑制CH3COOH的电离,电离平衡向左移动;
D.加纯H2SO4,H2SO4电离的H+,会抑制CH3COOH的电离,电离平衡向左移动;
所以电离程度最大的是B.
故选B.
点评 本题考查了弱电解质的电离,明确电离平衡的影响因素、弱电解质电离程度与溶液浓度的关系是解本题关键,题目难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
18.下列有关FeSO4•7H2O的叙述正确的是( )
| A. | 1molFeSO4•7H2O的质量为278g/mol | |
| B. | FeSO4•7H2O的摩尔质量为278g | |
| C. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 2.78g | |
| D. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 1.52g |
13.同温同压时,含相同分子数的H2O和NH3一定具有相同的( )
| A. | 体积 | B. | 原子个数 | C. | 质量 | D. | 电子数 |
10.铁和铁合金是生活中常见的材料,下列说法正确的是( )
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应生成四氧化三铁和氢气 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和熔点均低于铁合金 |
11.在盛有水的电解槽中加入含等物质的量的Ag+,Pb2+,K+,SO 2-,NO-,Br- 的物质,充分搅拌,然后用惰性电极电解,通电片刻后,氧化产物和还原产物的物质的量之比为( )
| A. | 1:2 | B. | 8:1 | C. | 1:1 | D. | 800:108 |
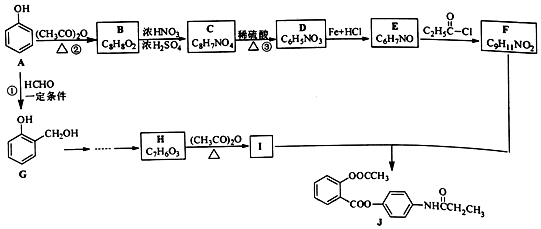
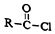 +R′-NH2→
+R′-NH2→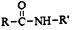 +HCl
+HCl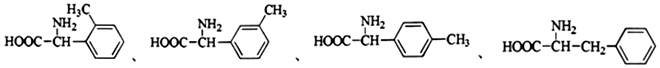 .
.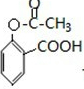 ;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;
;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;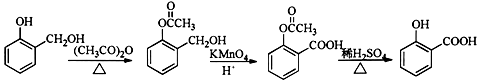 .
.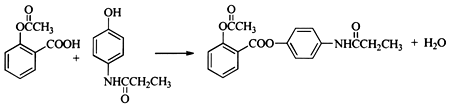 .
. A、B、C、D和E均为中学化学常见的纯净物,其中B为自然界中含量最多的液体,它们之间有如图反应关系:
A、B、C、D和E均为中学化学常见的纯净物,其中B为自然界中含量最多的液体,它们之间有如图反应关系: