题目内容
3.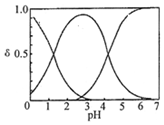 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9].下列说法正确的是( )| A. | 0.1mol•L-1H2C2O4溶液使KMnO4溶液褪色的离子方程式:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | 0.1 mol•L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
分析 由图可知①代表的是H2C2O4、②代表的是HC2O4-③代表的是C2O42-,由此分析:
A、锰元素化合价+7价变化为+2价,草酸中碳元素化合价+3甲变化为+4价;
B、由图可知,NaHC2O4溶液pH=3~4,证明溶液显示酸性,阴离子的电离程度大于其水解程度;
C、由图可知,pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4);
D、一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)?C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大.
解答 解:A、0.1mol•L-1H2C2O4溶液使KMnO4溶液褪色的离子方程式:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O,故A正确;
B、NaHC2O4溶液pH=4,证明溶液显示酸性,阴离子HC2O4-的电离程度大于其水解程度,所以c(H2C2O4)<c(C2O42-),故B正确;
C、pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(HC2O4-)>c(H2C2O4),故C错误;
D、一定温度下,往CaC2O4饱和溶液中,存在CaC2O4(s)?C2O42-(aq)+Ca2+(aq)平衡,加入少量CaCl2固体,平衡逆向移动,c(C2O42-)将减小,c(Ca2+)不可抵消,所以c(Ca2+)增大,故D错误;
故选AB.
点评 本题考查学生盐的水解原理的应用:离子浓度大小比较知识,注意知识的归纳和整理是关键,题目难度较大.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
13.同温同压时,含相同分子数的H2O和NH3一定具有相同的( )
| A. | 体积 | B. | 原子个数 | C. | 质量 | D. | 电子数 |
14.下列说法不正确的是( )
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HF比HCl稳定是因为HF间存在氢键 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
11.在盛有水的电解槽中加入含等物质的量的Ag+,Pb2+,K+,SO 2-,NO-,Br- 的物质,充分搅拌,然后用惰性电极电解,通电片刻后,氧化产物和还原产物的物质的量之比为( )
| A. | 1:2 | B. | 8:1 | C. | 1:1 | D. | 800:108 |
8.下列说法正确的是(已知NA为阿伏加德罗常数)( )
| A. | 标准状况下,22.4 L H2O所含的水分子数为NA | |
| B. | 常温常压下,16 g氧气所占的体积为11.2 L | |
| C. | 同温同压下,1 mol任何物质所占的体积相等 | |
| D. | 标准状况下,2NA个二氧化碳分子所占的体积为44.8 L |
15.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.
石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为:SO2+Ca(OH)2═CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,
反应为2CaSO3+O2+4H2O=2CaSO4•2H2O.其流程如图: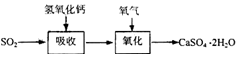
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.
其流程如图: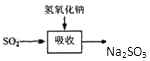
已知:
(1)石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是利用SO2是酸性氧化物,可与碱反应.和碱法相比,石灰-石膏法的优点是原料易得,吸收成本低.
(2)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.
石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为:SO2+Ca(OH)2═CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,
反应为2CaSO3+O2+4H2O=2CaSO4•2H2O.其流程如图:

碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.
其流程如图:

已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(2)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
11.高温、催化剂条件下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$恒容时,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 2CO2(g)+2H2(g)?2CO(g)+2H2O(g) 的平衡常数K1=K2 | |
| D. | 若恒容、恒温下充入CO,则K值变大 |
12. 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:
(1)等物质的量浓度的 a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为cbda(填字母).
(2)常温下,0.1mol•L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是B.
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)•C(OH-)
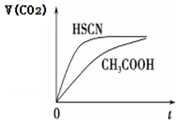
(3)25℃时,将 20mL 0.1mol•L-1 CH3COOH 溶液和 20mL0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快; 反应结束后所得两溶液中,(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=17.
(5)用离子方程式表示Na2CO3溶液呈碱性的原因CO32-+H2O?HCO3-+OH-.
 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(2)常温下,0.1mol•L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是B.
A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)•C(OH-)
(3)25℃时,将 20mL 0.1mol•L-1 CH3COOH 溶液和 20mL0.1mol•L-1HSCN溶液分别与20mL 0.1mol•L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快; 反应结束后所得两溶液中,(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
(4)25℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=17.
(5)用离子方程式表示Na2CO3溶液呈碱性的原因CO32-+H2O?HCO3-+OH-.
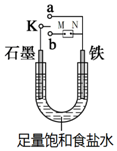 某课外活动小组同学用图1装置进行实验,试回答下列问题:
某课外活动小组同学用图1装置进行实验,试回答下列问题: