题目内容
10.下列关于Na2O2的说法中,错误的一项是( )| A. | 钠与氧气直接反应不能得到Na2O2 | |
| B. | Na2O2遇水剧烈反应放出O2,且每生成1 mol O2转移2 mol电子 | |
| C. | Na2O2与CO2可以反应放出O2,因此可以用作潜水艇的供氧剂 | |
| D. | Na2O2在空气中长时间暴露最后会生成Na2CO3 |
分析 A、钠与氧气在加热条件下可生成Na2O2;
B、Na2O2遇水剧烈反应放出O2,O元素化合价由-1升高到0价;
C、根据过氧化钠的性质和用途来回答;
D、Na2O2与空气中水、二氧化碳反应最终生成Na2CO3.
解答 解:A、钠与氧气在加热条件下可生成Na2O2,故A错误;
B、Na2O2遇水剧烈反应放出O2,O元素化合价由-1升高到0价,所以每生成1 mol O2转移2 mol电子,故B正确;
C、Na2O2能和二氧化碳反应生成碳酸钠和氧气,所以可用作供氧剂,故C正确;
D、Na2O2与空气中水、二氧化碳反应最终生成Na2CO3,故D正确;
故选:A;
点评 本题主要考查了过氧化钠的性质和用途,难度不大,注意基础知识的积累.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
1.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L氢气中含有2NA个中子 | |
| B. | 0.1NA个氯化氢分子占有体积为2.24L | |
| C. | 2克金属钙变成钙离子时失去的电子数为0.1NA | |
| D. | 50mL0.1mol/L H2SO4溶液中含有H+数为0.005NA |
18.下列有关FeSO4•7H2O的叙述正确的是( )
| A. | 1molFeSO4•7H2O的质量为278g/mol | |
| B. | FeSO4•7H2O的摩尔质量为278g | |
| C. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 2.78g | |
| D. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 1.52g |
5.下列实验操作能够达到实验目的是( )
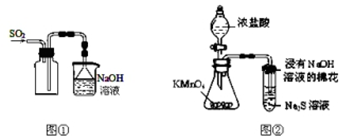

| A. | 实验室采用图①所示装置收集SO2 | |
| B. | 除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 | |
| C. | 称取0.40 g NaOH,置于100 mL容量瓶中,加水溶解,配制0.10 mol/L NaOH溶液 | |
| D. | 可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
15.在下列反应中,水只作氧化剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | 2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑ |
2.某化工厂按如下步骤进行生产:①以煤为燃料煅烧碳酸钙;②用饱和Na2CO3溶液吸收步骤①中产生的CO2(转化为小苏打NaHCO3);③使步骤①中产生的CaO跟水反应生成消石灰;④消石灰跟Na2CO3溶液反应,所得产品之一循环利用.下列说法不正确的是( )
| A. | 生产过程中没有涉及到氧化还原反应 | |
| B. | 生产过程中没有涉及到置换反应 | |
| C. | 该厂生产的主要原料为煤、纯碱 | |
| D. | 该厂生产的最终产品是小苏打及烧碱 |
13.同温同压时,含相同分子数的H2O和NH3一定具有相同的( )
| A. | 体积 | B. | 原子个数 | C. | 质量 | D. | 电子数 |
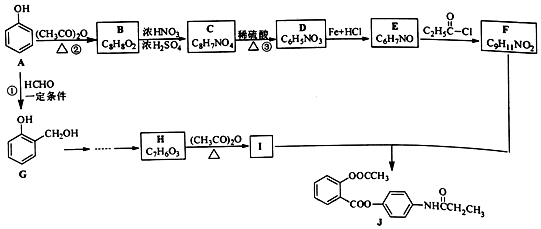
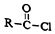 +R′-NH2→
+R′-NH2→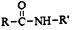 +HCl
+HCl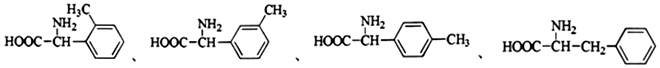 .
.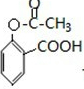 ;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;
;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;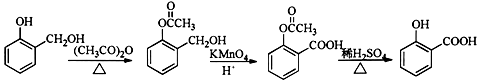 .
.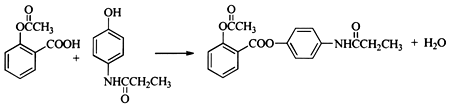 .
.