题目内容
5.下列各组物质中,化学键类型完全相同的是( )| A. | SO2和NaOH | B. | CO2和H2O | C. | Cl2和HCl | D. | CCl4和NaCl |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,据此分析解答.
解答 解:A.SO2中只有共价键,NaOH中存在离子键和共价键,故A错误;
B.CO2和H2O中都只存在极性共价键,故B正确;
C.Cl2分子中Cl原子之间存在非极性键,HCl中存在极性共价键,故C错误;
D.CCl4中只存在极性共价键,NaCl中只存在离子键,故D错误;
故选B.
点评 本题考查了化学键的判断,明确物质的构成微粒判断化学键即可,知道哪些元素易形成离子键,注意稀有气体中不存在化学键,为易错点.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
2.某化工厂按如下步骤进行生产:①以煤为燃料煅烧碳酸钙;②用饱和Na2CO3溶液吸收步骤①中产生的CO2(转化为小苏打NaHCO3);③使步骤①中产生的CaO跟水反应生成消石灰;④消石灰跟Na2CO3溶液反应,所得产品之一循环利用.下列说法不正确的是( )
| A. | 生产过程中没有涉及到氧化还原反应 | |
| B. | 生产过程中没有涉及到置换反应 | |
| C. | 该厂生产的主要原料为煤、纯碱 | |
| D. | 该厂生产的最终产品是小苏打及烧碱 |
13.同温同压时,含相同分子数的H2O和NH3一定具有相同的( )
| A. | 体积 | B. | 原子个数 | C. | 质量 | D. | 电子数 |
20.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | ${\;}_{17}^{35}$Cl2与${\;}_{17}^{37}$Cl2氧化能力相近,二者互为同位素 | |
| B. | .过氧化氢的电子式: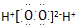 | |
| C. | .同主族元素形成的含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | .同周期主族元素原子半径随核电荷数的增大而减小 |
10.铁和铁合金是生活中常见的材料,下列说法正确的是( )
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应生成四氧化三铁和氢气 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和熔点均低于铁合金 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | S2和S8的混合物共6.4 g,所含硫原子数一定为0.2NA | |
| B. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01NA | |
| C. | 在反应KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3 mol Cl2,转移的电子数为6NA | |
| D. | 将含有1 mol Na2CO3的溶液逐滴加入到含1.5 mol HCl的溶液中,产生气体的分子数目为0.5NA |
14.下列说法不正确的是( )
| A. | CO2、SiO2的晶体结构类型不同 | |
| B. | 加热硅、硫晶体使之熔化,克服的作用力不同 | |
| C. | HF比HCl稳定是因为HF间存在氢键 | |
| D. | NaOH、NH4Cl晶体中既有离子键又有共价键 |
15.二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.
石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为:SO2+Ca(OH)2═CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,
反应为2CaSO3+O2+4H2O=2CaSO4•2H2O.其流程如图: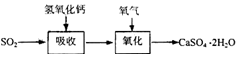
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.
其流程如图: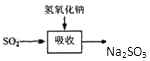
已知:
(1)石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是利用SO2是酸性氧化物,可与碱反应.和碱法相比,石灰-石膏法的优点是原料易得,吸收成本低.
(2)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.
石灰-石膏法和碱法是常用的烟气脱硫法.
石灰-石膏法的吸收反应为:SO2+Ca(OH)2═CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,
反应为2CaSO3+O2+4H2O=2CaSO4•2H2O.其流程如图:

碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.
其流程如图:

已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(2)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).