题目内容
10.下列对于Na2O、Na2O2的比较正确的一项是( )| A. | Na2O、Na2O2都是钠的氧化物,都是碱性氧化物 | |
| B. | Na2O、Na2O2都是易溶于水(与水反应)的白色固体 | |
| C. | Na2O2在和CO2的反应中既是氧化剂又是还原剂 | |
| D. | Na2O2与水反应时,1mol Na2O2转移2 mol电子 |
分析 A、碱性氧化物是能和酸反应生成盐和水的氧化物;
B、过氧化钠是淡黄色的固体,氧化钠是白色固体;
C、Na2O2和CO2的反应生成碳酸钠和氧气,根据化合价的变化确定反应物;
D、Na2O2与水反应生成氢氧化钠和氧气,根据化合价变化确定电子转移情况.
解答 解:A、过氧化钠能和酸反应生成盐和水,还生成氧气,不属于碱性氧化物,故A错误;
B、过氧化钠是淡黄色的固体,氧化钠是白色固体,故B错误;
C、Na2O2和CO2的反应生成碳酸钠和氧气,氧元素的化合价从-1价升高为0价,从-1价降低为-2价,所以过氧化钠既是氧化剂又是还原剂,故C正确;
D、Na2O2与水反应生成氢氧化钠和氧气,根据化合价变化得到1molNa2O2转移1mol电子,故D错误.
故选C.
点评 本题考查学生氧化钠和过氧化钠的化学性质等方面的知识,属于综合知识的考查,难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
1.下列物质分离过程中涉及共价键断裂的是( )
| A. | 用漏斗过滤,去除盐水中的CaCO3 | B. | 用饱和食盐水洗去Cl2中少量的HCl | ||
| C. | 用CCl4萃取碘水中的碘 | D. | 用升华法除去NaCl中混有的少量碘 |
1.经测量a滴水的体积为bmL,则1滴水中所含的分子数为( )
| A. | a×b×18×6.02×1023 | B. | $\frac{18b}{a}$×6.02×1023 | ||
| C. | $\frac{18a}{b}$×6.02×1023 | D. | $\frac{b}{18a}$×6.02×1023 |
15.K2Cr2O7+14HCl (浓)═2KCl+2CrCl3+3Cl2↑+7H2O,MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O.KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6mol/L)反应,MnO2需和浓盐酸(>8mol/L)反应.根据以上信息,下列结论中不正确的是( )
| A. | 上述反应既属于氧化还原反应,又属于离子反应 | |
| B. | 生成1 mol Cl2转移电子数均为2NA | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
2.可以证明酒精中含有水的物质是( )
| A. | 钠 | B. | 生石灰 | C. | 无水硫酸铜 | D. | 电石 |
19.根据如图,下列判断中正确的是( )
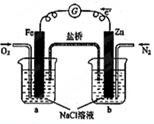

| A. | 向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成 | |
| B. | 烧杯b中发生反应为Zn+2e-=Zn2+ | |
| C. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| D. | 烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
 葡萄酒常用Na2S2O5做抗氧化剂.
葡萄酒常用Na2S2O5做抗氧化剂.