题目内容
19.根据如图,下列判断中正确的是( )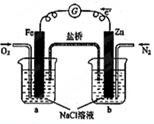
| A. | 向烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成 | |
| B. | 烧杯b中发生反应为Zn+2e-=Zn2+ | |
| C. | 电子从Zn极流出,流入Fe极,经盐桥回到Zn极 | |
| D. | 烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
分析 A、燃料电池的负极是氮气失电子的氧化反应,正极上是氧气得电子的还原反应;
B、烧杯B中是氮气失电子的氧化反应;
C、原电池中的电子是从负极流向正极;
D、烧杯a是原电池的正极,该电极上是氧气发生得电子的还原反应,根据电极反应式判断pH的变化.
解答 解:A、该装置是燃料电池,燃料电池的负极是氮气失电子的氧化反应,正极上是氧气得电子的还原反应,所以a中不存在亚铁离子,加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成,故A正确;
B、烧杯B中是氮气失电子的氧化反应,金属锌不参与化学反应,故B错误;
C、原电池中的电子是从负极流向正极,燃料氮气是负极,通入氧气的电极是正极,电子从Zn极流出,流入Fe极,不会经过电解质,故C错误;
D、烧杯a是原电池的正极,该电极上是氧气发生得电子的还原反应O2+4H++4e-=2H2O,消耗氢离子,溶液pH升高,故D错误.
故选A.
点评 本题考查学生原电池的工作原理以及燃料电池的电极反应规律,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
9. 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )| 编号 | a | b | c |
| A | Na | Na2O | NaOH |
| B | Al2O3 | NaAlO2 | Al(OH)3 |
| C | CO2 | Na2CO3 | NaHCO3 |
| D | Fe | FeCl3 | Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
10.下列对于Na2O、Na2O2的比较正确的一项是( )
| A. | Na2O、Na2O2都是钠的氧化物,都是碱性氧化物 | |
| B. | Na2O、Na2O2都是易溶于水(与水反应)的白色固体 | |
| C. | Na2O2在和CO2的反应中既是氧化剂又是还原剂 | |
| D. | Na2O2与水反应时,1mol Na2O2转移2 mol电子 |
11. 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.
(1)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气高温反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②除去烟气中的SO2,下列物质可作洗涤剂的是ab(填字母).
a.NaOH b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H=+183kJ•mol-1.
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8.0×10-4mol.该温度下的平衡常数K=4×10-6(科学计数法表示,保留两位有效数字).
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量
增大的原因:该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量增大.
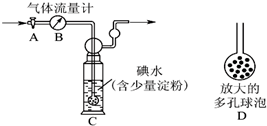
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
①写出该反应的离子方程式SO2+I2+2H2O=SO42-+2I-+4H+.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是增大SO2与碘水的接触面积,使SO2和碘水充分反应.
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量偏低(填“偏高”、“偏低”或“无影响”).
(4)将某PM2.5样本用蒸馏水处理制成待测试液.
若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如表:
根据表中数据判断该待测试液酸碱性为酸性.(填“酸性”、“中性”、“碱性”或“不确定”)
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.(1)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气高温反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+13l.3kJ•mol-1.
②除去烟气中的SO2,下列物质可作洗涤剂的是ab(填字母).
a.NaOH b.Na2CO3 c.CaCl2 d.NaHSO3
(2)已知汽车发动机工作时汽缸中生成NO的反应为:N2(g)+O2(g)?2NO(g)△H=+183kJ•mol-1.
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8.0×10-4mol.该温度下的平衡常数K=4×10-6(科学计数法表示,保留两位有效数字).
汽车启动后,汽缸温度越高,单位时间内NO排放量越大,请用反应速率和化学平衡知识解释NO排放量
增大的原因:该反应是吸热反应,温度升高,反应速率加快,平衡向正反应方向移动,因此单位时间内NO排放量增大.
(3)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放.某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,采用以下方案:如图所示,图中气体流量计B用于准确测量通过的尾气体积.将尾气通入一定体积已知浓度的碘水中测定SO2的含量.当洗气瓶C中溶液蓝色消失时,立即关闭活塞A.
①写出该反应的离子方程式SO2+I2+2H2O=SO42-+2I-+4H+.
②洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是增大SO2与碘水的接触面积,使SO2和碘水充分反应.
③洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量偏低(填“偏高”、“偏低”或“无影响”).
(4)将某PM2.5样本用蒸馏水处理制成待测试液.
若测得该试液所含水溶性无机离子的化学组分及其平均浓度[c(H+)、c(OH-)待测]如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
9.下列关于物质用途的叙述中不正确的是( )
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |