题目内容
18.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
分析 由元素在周期表的位置可知,①②③④⑤⑥⑦⑧⑨⑩分别为C、N、O、F、Na、Al、Si、S、Cl、Ar,
(1)周期表中左下角的金属性最强,Si为常见的半导体材料,N元素的气态氢化物与其最高价氧化物的水化物可直接化合生成铵盐;
(2)具有相同电子排布的离子,原子序数大的离子半径小;
(3)非金属性越强,气态氢化物越稳定;
(4)同主族,从上到下非金属性减弱;
(5)高氯酸为含氧酸中酸性最强的酸;短周期中Na的金属性最强,其对应碱NaOH与高氯酸反应生成高氯酸钠和水.
解答 解:由元素在周期表的位置可知,①②③④⑤⑥⑦⑧⑨⑩分别为C、N、O、F、Na、Al、Si、S、Cl、Ar,
(1)上表中左下角的金属Na金属性最强,最不活泼的元素是Ar,Si为常见的半导体材料,N元素的气态氢化物与其最高价氧化物的水化物可直接化合生成铵盐,
故答案为:Na;Ar;Si;N;
(2)具有相同电子排布的离子,原子序数大的离子半径小,则离子半径更大为F-,故答案为:F-;
(3)非金属性越强,气态氢化物越稳定,则更稳定的为HCl,故答案为:HCl;
(4)同主族,从上到下非金属性减弱,则非金属性①>⑦,故答案为:>;
(5)高氯酸为含氧酸中酸性最强的酸,该酸的化学式为HClO4;短周期中Na的金属性最强,其对应碱NaOH的碱性最强,其NaOH与高氯酸反应生成高氯酸钠和水,反应的化学方程式为,
故答案为:HClO4;NaOH; HClO4+NaOH=NaClO4+H2O.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素的性质推断元素为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
8.设NA为阿伏伽德罗常数,根据Cu+4NNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,则下列叙述正确的是( )
| A. | 22.4LNO2含电子总数为23NA | |
| B. | 3.6gH2O中含有共价键的总数为0.2NA | |
| C. | 若生成的硝酸铜浓度为2mol/L,则1L该溶液中含有的Cu2+数为2N | |
| D. | 若有2molCu参与反应,则有4molHNO3被还原 |
7.如表为元素周期表的短周期部分.
请参照元素a-g在表中的位置,根据判断出的元素回答问题:
(1)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;
(2)b、c两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为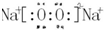 ;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
| a | |||||||
| b | c | d | |||||
| e | f | g |
(1)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;
(2)b、c两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为
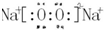 ;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
;b、g元素形成的bg2作为溶剂可溶解S单质(填写该单质“名称”或“化学式”)
12.能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)<c(H+)的操作是( )
| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加醋酸钠晶体 |
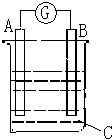 请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,
请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,