题目内容
13.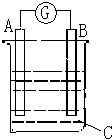 请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,
请根据如图所示回答:甲装置是由铜、锌和硫酸铜组成的原电池,(1)其中正极材料是铜,
(2)负极反应式为:Zn-2e-=Zn2+
(3)总的电极反应式表示为Cu2++Zn=Zn2++Cu.
(4)当导线中有2mol电子通过时,理论上两极的变化是AD填序号).
A.锌片溶解了65g B.锌片增重65g
C.铜片上析出63.5g Cu D.铜片上析1mol Cu.
分析 该原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上铜离子得电子发生还原反应,在得失电子相等的条件下,将正负极电极反应式相加即得电池反应式.
解答 解:(1)该原电池中,锌易失电子作负极,铜作正极,故答案为:铜;
(2)锌易失电子生成锌离子而作负极,电极反应式为:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(3)在得失电子相等的条件下,将正负极电极反应式相加即得电池反应式,所以电池反应式为Cu2++Zn=Zn2++Cu,故答案为:Cu2++Zn=Zn2++Cu;
(4)当导线中有2mol电子通过时,负极发生Zn-2e-=Zn2+,消耗1mol锌,质量为65g,正极发生Cu2++2e-=Cu,生成1mol铜,质量为64g,故答案为:AD.
点评 本题综合考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握电极方程式的书写,为解答该题的关键,题目难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
3.要证明CuSO4溶液显蓝色不是由于SO42-造成的,下列实验无意义的是( )
| A. | 观察K2SO4溶液的颜色 | |
| B. | 加水稀释CuSO4溶液,溶液颜色变浅 | |
| C. | 向CuSO4溶液中滴加过量NaOH溶液,振荡后静置,溶液变成无色 | |
| D. | 向CuSO4溶液中滴加过量Ba(NO3)2溶液,振荡后静置,溶液未变成无色 |
1.25℃时,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质.有关结论正确的是
( )
( )
| 加入的物质 | 结论 | |
| A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 若反应完全后溶液的体积仍为100mL,则溶液的pH约为14 |
| C | 50mL H2O | c(Na+)=2[c(CO32-)+c(HCO3-)] |
| D | 0.1mol NaHSO4 | 反应完全后,溶液pH减小,c (Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
8.下列叙述中正确的是( )
| A. | 共价化合物分子中的化学键可能含有离子键 | |
| B. | 含有金属元素的化合物-定是离子化合物 | |
| C. | 需要加热才能发生的反应是吸热反应 | |
| D. | 反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放的能量的大小 |
18.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①-⑩中,最活泼的金属元素是Na(写元素符号,下同);最不活泼的元素是Ar;可作半导体材料的元素是Si;某元素的气态氢化物与其最高价氧化物的水化物可直接 化合生成一种盐,该元素是N.
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
5.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 利用海水制取氯化钠、烧碱、纯碱、氯气等物质都发生了氧化还原反应 | |
| B. | 蛋白质、葡萄糖、纤维素、油脂等都能在人体内水解并提供能量 | |
| C. | 为了提高生活用水的卫生标准,自来水厂常使用Cl2和CuSO3•5H2O进行消毒、净化、以改善水质 | |
| D. | 塑料、合成橡胶和纤维这三大合成材料,都主要以石油、煤和天然气为原料生产的 |
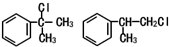
 (X为卤素原子)
(X为卤素原子)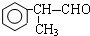 的物质,该物质是一种香料.
的物质,该物质是一种香料.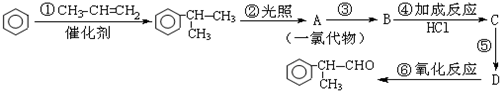
 .
.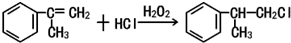 .
.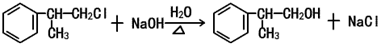 .
.