题目内容
12.能影响水的电离平衡,最终使水电离的离子在溶液中表现为c(OH-)<c(H+)的操作是( )| A. | 向水中投入一小块金属钠 | B. | 将水加热煮沸 | ||
| C. | 向水中通入二氧化碳气体 | D. | 向水中加醋酸钠晶体 |
分析 酸或碱抑制水电离,含有弱离子的盐促进水电离,使水电离的离子在溶液中表现为c(OH-)<c(H+),说明该溶液呈酸性,溶液中的溶质为酸、强酸强碱酸式盐或强酸弱碱盐,据此分析解答.
解答 解:A.加入金属钠,和水电离出的H+反应生成NaOH和氢气,c(H+)降低,使水的电离向右移动,碱性增强,则c(H+)<c(OH-),故A错误;
B.将水加热煮沸,促进水电离,但溶液中仍然存在c(H+)=c(OH-),溶液呈中性,故B错误;
C.向水中通入CO2 后,CO2与水结合产生碳酸,碳酸电离产生H+,使得c(H+)>c(OH-),抑制水电离,故C正确;
D.向水中加入醋酸钠晶体,CH3COO-与水电离出的H+反应生成CH3COOH,导致水的电离平衡向右移动,碱性增强,c(H+)<c(OH-),故D错误;
故选C.
点评 本题考查探究溶液酸碱性判断及水的电离,为高频考点,明确水电离影响因素是解本题关键,溶液酸碱性要根据溶液中c(H+)、c(OH-)相对大小判断,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①-⑩中,最活泼的金属元素是Na(写元素符号,下同);最不活泼的元素是Ar;可作半导体材料的元素是Si;某元素的气态氢化物与其最高价氧化物的水化物可直接 化合生成一种盐,该元素是N.
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
3.下列关于氯的说法正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | Cl-、Cl为不同的核素,有不同的化学性质 | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 电解饱和食盐水制氯气时,与电源负极相连的石墨棒上方充满黄绿色气体 |
20.日本福岛核电站的核原料铀235(235 92U)裂变释放出具有放射性的碘131(53131I)和铯137(55137Cs),下列说法正确的是( )
| A. | 127I与131I互为同素异形体 | B. | 137Cs的核电荷数为137 | ||
| C. | 铀235的中子数是143 | D. | 铯与水的反应比钠与水的反应缓慢 |
4.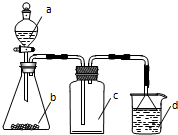 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).用此装置和表中提供的物质能完成相关实验的是( )| 选项 | a中物质 | b中物质 | c中的气体 | d中物质 |
| A | 浓氨水 | CaO | NH3 | H2O |
| B | 稀硝酸 | Cu | NO | H2O |
| C | 硫酸 | Na2CO3 | CO2 | NaOH溶液 |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
1.下列有关离子共存的说法及相关分析正确的是( )
| 选项 | 离子组 | 分析 |
| A | 含大量Al3+的溶液中:K+、Na+、NO3-、CO32- | 不能大量共存,因有Al2(CO3)3沉淀生成 |
| B | 含大量Fe3+的溶液中:K+、Mg2+、I-、NO3- | 不能大量共存,因2Fe3++2I-=2Fe2++I2 |
| C | 由水电离的c(H+)=1×10-14mol/L的溶液中: Ca2+、NO3-、HCO3-、Cl- | 不能大量共存,因溶液呈酸性,与HCO3-反应产生CO2气体 |
| D | 使酚酞变红的溶液中: Na+、K+、SO32-、S2- | 不能大量共存,因SO32-和S2-反应产生淡黄色的S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
2.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如表所示.已知X元素最低负化合价的绝对值与其原子最外层电子数相等,Y是地壳中含量最多的金属元素.下列说法错误的是( )
| X | ||||
| Z | W |
| A. | X和氢组成的化合物分子中可能含有极性共价键和非极性共价键 | |
| B. | 工业上用电解Y和W组成的化合物来制备Y | |
| C. | Z、W两元素的气态氢化物中,W的气态氢化物更稳定 | |
| D. | X、Y、Z、W元素最高价氧化物对应的水化物中酸性最强的是HWO4 |
 (X为卤素原子)
(X为卤素原子)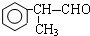 的物质,该物质是一种香料.
的物质,该物质是一种香料.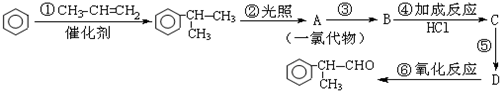
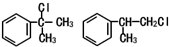 .
.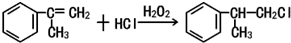 .
.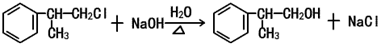 .
.