题目内容
9.有机物A由碳、氢、氧三种元素组成.现取3gA与4.48L氧气(标准状况)在密闭容器中燃烧,生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g.求:(1)水的物质的量;
(2)二氧化碳的物质的量
(3)3gA中所含氢原子的物质的量.
分析 (1)浓硫酸增重3.6g为水的质量,根据n=$\frac{m}{M}$计算水的物质的量;
(2)碱石灰增重4.4g为二氧化碳的质量,根据n=$\frac{m}{M}$计算二氧化碳;
(3)根H氧原子守恒计算.
解答 解:(1)浓硫酸增重3.6g为水的质量,n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
答:水的物质的量为0.2mol;
(2)碱石灰增重4.4g为二氧化碳的质量,n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,
答:二氧化碳的物质的量为:0.1;
(3)由H原子守恒可知3gA中n(H)=2n(H2O)=2×0.2 mol=0.4mol,
答:3gA中所含氢原子的物质的量为0.4mol.
点评 本题考查有机物的确定,题目难度不大,注意浓硫酸和碱石灰增重的原因,再结合原子守恒计算,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
14.常温下,物质的量浓度相同的下列溶液中,符合pH由小到大顺序排列的是( )
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | B. | NaHCO3 Na2CO3 NH4Cl NaCl. | ||
| C. | NH4Cl (NH4)2SO4 Na2S NaNO3 | D. | (NH4)2SO4 NH4Cl NaNO3 NaHCO3 |
1.25℃时,将0.05mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质.有关结论正确的是
( )
( )
| 加入的物质 | 结论 | |
| A | 50mL 1mol/L H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 若反应完全后溶液的体积仍为100mL,则溶液的pH约为14 |
| C | 50mL H2O | c(Na+)=2[c(CO32-)+c(HCO3-)] |
| D | 0.1mol NaHSO4 | 反应完全后,溶液pH减小,c (Na+)不变 |
| A. | A | B. | B | C. | C | D. | D |
18.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①-⑩中,最活泼的金属元素是Na(写元素符号,下同);最不活泼的元素是Ar;可作半导体材料的元素是Si;某元素的气态氢化物与其最高价氧化物的水化物可直接 化合生成一种盐,该元素是N.
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
3.下列关于氯的说法正确的是( )
| A. | Cl2具有很强的氧化性,在化学反应中只能作氧化剂 | |
| B. | Cl-、Cl为不同的核素,有不同的化学性质 | |
| C. | 实验室制备Cl2,可用排饱和食盐水集气法收集 | |
| D. | 电解饱和食盐水制氯气时,与电源负极相连的石墨棒上方充满黄绿色气体 |
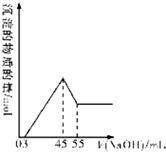 准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示:
准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示: