题目内容
8.设NA为阿伏伽德罗常数,根据Cu+4NNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,则下列叙述正确的是( )| A. | 22.4LNO2含电子总数为23NA | |
| B. | 3.6gH2O中含有共价键的总数为0.2NA | |
| C. | 若生成的硝酸铜浓度为2mol/L,则1L该溶液中含有的Cu2+数为2N | |
| D. | 若有2molCu参与反应,则有4molHNO3被还原 |
分析 A、气体所处的状态不明确;
B、求出水的物质的量,然后根据水中含2条共价键来分析;
C、铜离子为弱碱阳离子,在溶液中会水解;
D、根据得失电子数守恒来分析.
解答 解:A、气体所处的状态不明确,故22.4L二氧化氮的物质的量无法计算,则含有的电子总数无法计算,故A错误;
B、3.6g水的物质的量为0.2mol,而水中含2条共价键,故0.2mol水中含0.4NA条共价键,故B错误;
C、铜离子为弱碱阳离子,在溶液中会水解,故溶液中的铜离子的个数小于2NA个,故C错误;
D、2mol铜失去4mol电子,而硝酸被还原为二氧化氮,根据得失电子数守恒可知,被还原的硝酸为4mol,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 氢氧化铁胶体 | B. | 乙醇溶液 | C. | 氯化钠溶液 | D. | 纯净的空气 |
3.要证明CuSO4溶液显蓝色不是由于SO42-造成的,下列实验无意义的是( )
| A. | 观察K2SO4溶液的颜色 | |
| B. | 加水稀释CuSO4溶液,溶液颜色变浅 | |
| C. | 向CuSO4溶液中滴加过量NaOH溶液,振荡后静置,溶液变成无色 | |
| D. | 向CuSO4溶液中滴加过量Ba(NO3)2溶液,振荡后静置,溶液未变成无色 |
18.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.
(1)①-⑩中,最活泼的金属元素是Na(写元素符号,下同);最不活泼的元素是Ar;可作半导体材料的元素是Si;某元素的气态氢化物与其最高价氧化物的水化物可直接 化合生成一种盐,该元素是N.
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
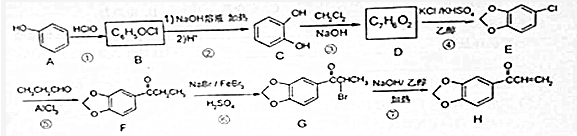
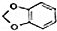 .
.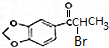 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O.
+NaBr+H2O. 等(写出其中一种的结构简式).
等(写出其中一种的结构简式). 的合成路线.
的合成路线.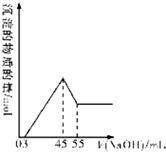 准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示:
准确称取10.0g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol/L的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积关系如图所示: