题目内容
3.硝酸与金属反应时,浓度不同生成的还原产物也可能不同.某兴趣小组进行了如下实验探究.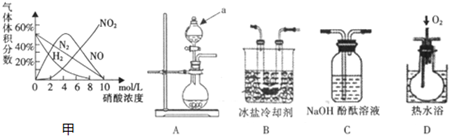
[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示;
b.NO2沸点:21℃;NO沸点:-151℃;
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2+H2O.
(1)请写出Mg放入10mol/L硝酸中反应的化学方程式:Mg+4HNO3=Mg(NO3)2+2H2O+2NO2↑.
[实验探究]该小组拟选用如图ABCD所示装置探究镁与4mol/L硝酸反应的产物.
连接装置A-B-C-D-C,检查气密性,按图示加入试剂,D中通入的O2微过量.
(2)a仪器的名称是分液漏斗.
(3)前一个C装置的装置是吸收未被冷却的二氧化氮,证明气体产物中有NO生成的实验现象是C中酚酞溶液不褪色,D装置中有红棕色气体出现.
(4)从后一个C装置中溢出的氮气和氢气,溶液中还可能有一种还原产物,这种还原产物可能是硝酸铵,请设计实验验证你的猜想取少量A中溶液于试管中,加入过量浓氢氧化钠溶液,用湿润的粉红色石蕊试纸放在试管口,微热试管如果红色石蕊试纸变蓝,则可证明铵根离子产生,产物中含硝酸铵.
分析 (1)根据图象可知,Mg放入10mol/L硝酸中产生二氧化氮,根据电子得失守恒和元素守恒书写化学方程式;
(2)根据装置图可知仪器a的名称为分液漏斗;
(3)前一个C装置是吸收未被冷却的二氧化氮,一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮;
(4)在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收;
硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,可以用氢氧化钠溶液及红色石饭蕊试纸检验.
解答 解:(1)根据图象可知,Mg放入10mol/L硝酸中产生二氧化氮,反应的化学方程式为Mg+4HNO3=Mg(NO3)2+2H2O+2NO2↑,
故答案为:Mg+4HNO3=Mg(NO3)2+2H2O+2NO2↑;
(2)根据装置图可知仪器a的名称为分液漏斗,
故答案为:分液漏斗;
(3)前一个C装置是吸收未被冷却的二氧化氮,防止其对后面一氧化氮的检验产生影响,一氧化氮为无色气体,遇到空气中的氧气能被氧化成红棕色的二氧化氮,所以看到C中酚酞溶液不褪色,D装置中有红棕色气体出现,则证明体产物中有NO生成,
故答案为:吸收未被冷却的二氧化氮;C中酚酞溶液不褪色,D装置中有红棕色气体出现;
(4)在D装置中一氧化氮被氧化成二氧化氮,二氧化氮被氢氧化钠吸收,氢气和氮气不能被吸收,所以从后一个C装置中逸出的气体主要是氮气和氢气,硝酸被还成氮的氧化物都为气体,如果不是气体根据化合升降规则可知,应为铵盐,生成的为硝酸铵,可以在所得溶液中加入浓氢氧化钠溶液并微热,用湿润的红色石蕊试纸检验,如果红色石蕊试纸变蓝,则可证明的铵根离子产生,产物中含有硝酸铵,
故答案为:氮气和氢气;硝酸铵;取少量A中溶液于试管中,加入过量浓氢氧化钠溶液,用湿润的粉红色石蕊试纸放在试管口,微热试管如果红色石蕊试纸变蓝,则可证明铵根离子产生,产物中含硝酸铵.
点评 本题考查反应产物的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | Na2CO3 NaHCO3 NaCl NH4Cl | B. | NaHCO3 Na2CO3 NH4Cl NaCl. | ||
| C. | NH4Cl (NH4)2SO4 Na2S NaNO3 | D. | (NH4)2SO4 NH4Cl NaNO3 NaHCO3 |
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化 物反应的化学方程式为HClO4+NaOH=NaClO4+H2O.
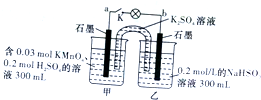
| A. | 电池工作时,甲烧杯中由烧杯中由水电离出的c(H+)逐渐减小 | |
| B. | 电池工作时,盐桥中的“K+”移向甲烧杯,外电路的方向是从b到a | |
| C. | 当电路中有1.204×1021个电子转移时,乙烧杯中溶液的pH约为2 | |
| D. | 乙池中的氧化产物为SO${\;}_{4}^{2-}$ |
| A. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 | |
| B. | 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 | |
| C. | 洗涤的操作是向过滤器里的固体加洗涤剂,使洗涤剂浸没固体,待洗涤剂自然流下 | |
| D. | 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 |
K+、Cl-、NH${\;}_{4}^{+}$、Mg2+、Ba2+、CO${\;}_{3}^{2-}$.、SO${\;}_{4}^{2-}$.
将该混合物溶于水后得无色澄清溶液,现分别取3份100mL该溶液进行如下实验:
| 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| c | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27 g,第二次称量读数为2.33 g |
(1)根据实验1对Cl-是否存在的判断是不能确定(填“一定存在”“一定不存在”或“不能确定”);
(2)根据实验1~3判断原混合物中一定不存在的离子是Mg2+、Ba2+;
(3)若溶液中含有Cl-,则K+的物质的量应满足的条件是c(K+)>0.2mol/L.
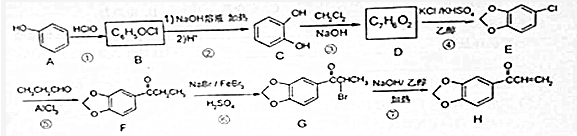
 .
.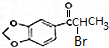 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O.
+NaBr+H2O. 等(写出其中一种的结构简式).
等(写出其中一种的结构简式). 的合成路线.
的合成路线. 2,3,4-三甲基己烷,
2,3,4-三甲基己烷, 3-甲基-3-乙基己烷,
3-甲基-3-乙基己烷, 3,3-二甲基-4-乙基-3-己烯,
3,3-二甲基-4-乙基-3-己烯, 2,3-二甲基-2-丁烯.
2,3-二甲基-2-丁烯.