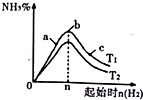
题目内容
14.下列防止金属腐蚀的做法不可行的是( )| A. | 在铁制的炒锅、蒸锅等炊具上镀铜、防止生锈 | |
| B. | 地下钢铁管道连接镁块来防止钢铁锈蚀 | |
| C. | 健身器材刷油漆以防锈 | |
| D. | 洗衣机的滚筒采用不锈钢材料、既耐磨又耐腐蚀 |
分析 钢铁生锈的条件是钢铁与氧气和水同时接触.酸性溶液、碱性溶液、盐溶液能促进金属生锈,防止金属生锈的方法有:在金属表面涂一层油漆;在金属表面镀一层金属等.
解答 解:A、在铁制的炒锅、蒸锅等炊具上镀铜,这样形成的原电池中,金属铁为负极,会加快锈蚀速率,故A错误;
B、埋在地下的钢铁管道连接镁块,这样形成的原电池中,金属镁块为负极,铁作正极被保护,则能防止钢铁锈蚀,故B正确;
C、健身器材刷油漆,可以防止Fe与空气接触,可以防止生锈,故C正确;
D、不锈钢材料、既耐磨又耐腐蚀,可以防止生锈,故D正确.
故选A.
点评 本题考查金属的防护,注意解答本题要充分理解铁生锈的条件和防止铁生锈的方法,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.分子式为C4H8的烯烃共有(要考虑顺反异构体)几种结构( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
5.对于溶液中的反应,不影响反应速率的因素是( )
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
9.以下是对某水溶液进行离子检验的方法和结论,其中不正确的是( )
| A. | 先加入BaCl2溶液,产生了白色沉淀,再加入足量的HCl溶液,沉淀不溶解,溶液中一定含有大量SO${\;}_{4}^{2-}$ | |
| B. | 加入足量的CaCl2溶液,产生了白色沉淀,加入盐酸可以产生无色且能使澄清石灰水变浑浊的气体,则该溶液不一定含有大量的CO${\;}_{3}^{2-}$ | |
| C. | 加入足量浓 NaOH溶液加热,产生了带有强烈刺激性气味的能使湿润的红色石蕊试纸变蓝的气体,溶液中一定含有大量的NH${\;}_{4}^{+}$ | |
| D. | 先加适量的硝酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀.溶液中一定含有大量的Cl- |
19.下列叙述中,正确的是( )
| A. | 胶体属于介稳体系 | |
| B. | 蒸发操作中主要仪器是坩埚 | |
| C. | 粗盐经过溶解、过滤、蒸发后得到的是纯净的食盐 | |
| D. | NH4NO3不属于盐 |
6.向 500mLFeCl3溶液中通入一定量的 H2S气体,恰好完全反应,所得滤液的质量比原来增重1g,则原 FeCl3溶液的物质的量浓度为( )
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |
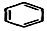 +H2C═CH2$\stackrel{一定条件}{→}$
+H2C═CH2$\stackrel{一定条件}{→}$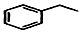
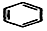 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$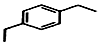
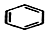 +2H2C═CH2$\stackrel{一定条件}{→}$
+2H2C═CH2$\stackrel{一定条件}{→}$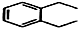
 .
.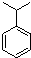 . N:
. N: .
.