题目内容
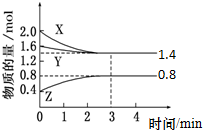 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
考点:物质的量或浓度随时间的变化曲线
专题:
分析:A.根据v(X)=
计算X的反应速率;
B.根据反应中各物质的物质的量的变化的比例得到反应中各计量数之比;
C.根据反应中各物质的浓度对平衡的影响判断;
D.只有温度影响化学平衡常数.
| ||
| △t |
B.根据反应中各物质的物质的量的变化的比例得到反应中各计量数之比;
C.根据反应中各物质的浓度对平衡的影响判断;
D.只有温度影响化学平衡常数.
解答:
解:A、根据v(X)=
计算得X的反应速率为
=0.1 mol?L-1?min-1,故A正确;
B、X、Y的物质的量均减小为反应物,变化量分别为:2.0-1.4=0.6mol,1.6-1.4=0.2mol,Z物质的量增大为生成物,变化量为:0.8-0.4=0.4mol,即三者的计量数之比为:3:1:2,化学方程式可写为:3X(g)+Y(g) 2Z(g),故B正确;
2Z(g),故B正确;
C、反应中充入惰性气体Ne,各反应物和生成物的浓度不变,所以平衡不移动,Y的转化率也不变,故C正确;
D、化学平衡常数只与温度有关系,浓度变化不影响化学平衡常数,故D错误;
故选D.
| ||
| △t |
| ||
| 3nim |
B、X、Y的物质的量均减小为反应物,变化量分别为:2.0-1.4=0.6mol,1.6-1.4=0.2mol,Z物质的量增大为生成物,变化量为:0.8-0.4=0.4mol,即三者的计量数之比为:3:1:2,化学方程式可写为:3X(g)+Y(g)
 2Z(g),故B正确;
2Z(g),故B正确;C、反应中充入惰性气体Ne,各反应物和生成物的浓度不变,所以平衡不移动,Y的转化率也不变,故C正确;
D、化学平衡常数只与温度有关系,浓度变化不影响化学平衡常数,故D错误;
故选D.
点评:本题考查化学平衡图象、化学方程式书写、平衡常数影响因素、化学反应速率的计算等,难度不大,注意掌握平衡移动原理

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
| C、向硝酸银溶液中逐滴滴入稀氨水至过量:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
X、Y两元素的原子分别得到2个电子形成稳定结构时,X放出的能量大于Y放出的能量;M、N两元素的原子分别失去1个电子形成稳定结构时N吸收的能量大于M吸收的能量.则X、Y、M、N四种元素中金属性最强的是( )
| A、N | B、M | C、X | D、Y |
将NaCl固体溶解在水中,下列相关描述不正确的是( )
| A、NaCl═Na++Cl- |
| B、NaCl溶液中存在自由移动的水合钠离子、水合氯离子 |
| C、该过程中,水分子的作用是氯化钠溶液能够导电的重要原因 |
| D、氯化钠固体中不存在钠离子、氯离子,所以氯化钠固体不导电 |
 (1)25℃时,0.1mol?L-1的HA溶液中
(1)25℃时,0.1mol?L-1的HA溶液中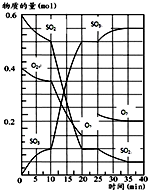 500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示.
500℃时,将SO2和O2置于一容积固定为2L的密闭容器中发生反应,反应过程中SO2、O2和SO3物质的量变化如图所示. 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.