题目内容
7.化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3.K为常见固态非金属单质,J为常见气态单质.其余为化合物,其中I、F在常温下为液态,C、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品.F的浓溶液与K加热可生成D和H.(部分生成物未标出)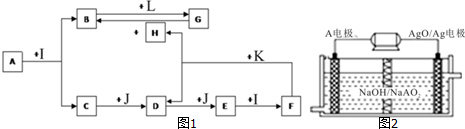
(1)写出下列物质的化学式:ESO3 JO2
(2)写出D通入足量稀Ba(NO3)2溶液反应的化学方程式:3SO2+3Ba(NO3)2+2H2O=3BaSO4↓+2NO+4HNO3
(3)银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故,根据电化学原理可进行如下处理,在铝制容器中加入食盐溶液,再将变黑的银器浸入该溶液中,一段时间后发现黑色会褪去,写出该反应的离子方程式2Al+3Ag2S+3H2O=2Al(OH)3+6Ag+3H2S↑
(4)A电池性能优越,A-AgO电池可用作水下动力电源,其原理如图2所示.该电池反应的化学方程式为:2A+3AgO+2NaOH=2NaAO2+3Ag+H2O,下列说法正确的是C
A.该隔膜是阳离子交换膜
B.当电极上析出1.08 g Ag时,电路中转移的电子为0.01 mol
C.A电极的反应式为:A-3e-+4OH-=AO2-+2H2O
D.正极的电极反应式为:O2+2H2O+4e-=4OH-.
分析 F的浓溶液与常见固态非金属单质K加热可生成刺激性气体D和无色无味气体H.中学里符合该反应的只有碳跟浓硫酸或与浓硝酸反应,即K为碳,C与J连续反应得到E,E与液体I反应得到F,可推知J为O2,I为H2O,离子化合物A在水中发生水解反应得到B与C,B为白色胶状沉淀,L为氯碱工业中的常见产品,二者反应得到G,可推知B为Al(OH)3,L为NaOH、G为NaAlO2,则F为浓硫酸符合图中的物质间转化,C为H2S,D为SO2,E为SO3,H为CO2,A为一种Al与S组成的化合物,根据阳离子与阴离子的个数比为2:3,即可得知A为Al2S3,据此解答.
解答 解:F的浓溶液与常见固态非金属单质K加热可生成刺激性气体D和无色无味气体H.中学里符合该反应的只有碳跟浓硫酸或与浓硝酸反应,即K为碳,C与J连续反应得到E,E与液体I反应得到F,可推知J为O2,I为H2O,离子化合物A在水中发生水解反应得到B与C,B为白色胶状沉淀,L为氯碱工业中的常见产品,二者反应得到G,可推知B为Al(OH)3,L为NaOH、G为NaAlO2,则F为浓硫酸符合图中的物质间转化,C为H2S,D为SO2,E为SO3,H为CO2,A为一种Al与S组成的化合物,根据阳离子与阴离子的个数比为2:3,即可得知A为Al2S3,
(1)根据上面的分析可知,E为SO3,J为O2,
故答案为:SO3;O2;
(2)D为SO2,D通入足量稀Ba(NO3)2溶液反应的化学方程式为3SO2+3Ba(NO3)2+2H2O=3BaSO4↓+2NO+4HNO3,
故答案为:3SO2+3Ba(NO3)2+2H2O=3BaSO4↓+2NO+4HNO3;
(3)在铝制容器中加入食盐溶液,再将变黑的银器即表面为Ag2S浸入该溶液中,铝能还原出银,同是生成氢氧化铝和硫化氢,反应的方程式为2Al+3Ag2 S+3H2O=2Al(OH)3+6Ag+3H2S↑,
故答案为:2Al+3Ag2 S+3H2O=2Al(OH)3+6Ag+3H2S↑;
(4)A.根据电池总反应可知,该原电池的负极电极反应式为A-3e-+4OH-=AO2-+2H2O,正反应式为AgO+H2O+2e-=Ag+2OH-,所以该隔膜是阴离子交换膜,使氢氧根离子通过,故A错误;
B.根据电极反应AgO+H2O+2e-=Ag+2OH-,当电极上析出1.08 g即0.01mol Ag时,电路中转移的电子为0.02 mol,故B错误;
C.A电极的反应式为:A-3e-+4OH-=AO2-+2H2O,故C正确;
D.正极的电极反应式为:AgO+H2O+2e-=Ag+2OH-,故D错误,
故选C.
点评 本题考查无机物推断,该题突破口是:F的浓溶液与常见固态非金属单质K加热可生成刺激性气体D和无色无味气体H,再结合题目信息及转化关系推断,需要学生熟练掌握元素化合物性质,难度较大.

(1)甲醇分子是极性分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的$\frac{3}{5}$.
①达到平衡时,CO的转化率为60%
②下列选项能判断该反应达到平衡状态的依据的有ce
a.2v(H2)=v(CH3OH)
b.CO的消耗速率等于CH3OH的生成速率
c.容器内的压强保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1
②2CO(g)+O2(g)═2CO2(g)△H=-bkl•mol-1
③H2O(g)═H2O(1)△H=-ckJ•mol-1
则CH3OH(1)+O2(g)═CO(g)+2H2O(1)△H=$\frac{b-a-4c}{2}$kJ•mol-1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②若以该电池为电源,用石墨做电极电解200mL含有如表离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| 浓度(c/mol•L-1) | 0.5 | 2 | 2 | 0.5 |
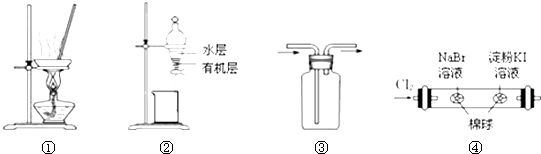
| A. | 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 用图②所示装置,分离CCl4萃取碘水后的有机层和水层 | |
| C. | 按装置③所示的气流方向可用于收集H2、NH3等 | |
| D. | 用图④所示装置,可以证明氧化性:Cl2>Br2>I2 |
 已知室温下,某些弱酸的电离常数如下:
已知室温下,某些弱酸的电离常数如下:| CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.7×10-5 | Ka1=4.2.×10-7 Ka2=5.6.×10-11 | 3×10-8 |
a.盐酸溶液 b.硫酸溶液 c.次氯酸溶液 d.醋酸溶液
①H+由大到小的顺序是:b、a、d、c(填字母)
②等体积a、b、d三种溶液与足量的锌完全反应,在相同的条件下,生成氢气的体积关系为b>a=d或b=2a=2d(用字母及“>”“<”“=”表示)
③欲降低稀硫酸与足量锌生成氢气速率,但不影响产生氢气的物质的量,下列措施可行的是abd
a.加水稀释 b.加入Na2SO4溶液 c.加入Na2CO3固体 d.加入CH3COONa固体
(2)某温度下pH均为4的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化如图所示,其中表示醋酸的曲线是b,该醋酸溶液稀释过程中,下列各量一定变小的是AC
A.c(H+) B.$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$ C.$\frac{c(C{H}_{3}COOH)}{c({H}^{+})}$
(3)新制饱和氯水中存在Cl2+H2O?HCl+HClO,为使HClO浓度增大,下列措施可行的B
A.加少量NaOH固体 B.加CaCO3固体 C.加NaCl固体.
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为NaH,丁物质中阴离子与阳离子的个数之比为1:2.
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为H2O2?H++HO2-.
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如图1:
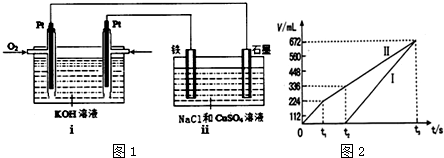
①写出ⅰ中通入该物质这一极的电极反应式CH3OH-6e-+8OH-=CO32-+6H2O.
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图2所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式2 H2O-4e-=O2↑+4 H+;;原混合液中CuSO4溶液物质的量浓度为0.1 mol/L.

