题目内容
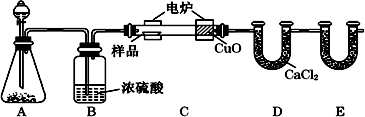
20.纳米级Fe粉是新型材料,具有超强磁性、高效催化性.某化学小组探究用氢气和碳酸亚铁制取纳术级铁粉.其实验设计如图1(加热、夹持装置省略)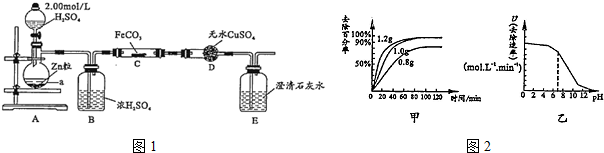
(l)a的名称是蒸馏烧瓶;浓硫酸的作用是干燥氢气.
(2)打开分液漏斗活塞,一段时间后再对C装置加热,这样操作的目的是排出体系内的空气,防止干拢实验,防止爆炸;反应一段时间后D中变蓝.E中溶液变浑浊,C中发生反应的化学方程式是FeCO3+H2$\frac{\underline{\;\;△\;\;}}{\;}$Fe+CO2+H2O.
(3)反应中若观察到B装置中气泡产生过快,则应进行的操作是调节A中分液漏斗活塞,减缓硫酸滴加速度.
(4)将酒精灯换成酒精喷灯,按上述操作.D中变蓝,E中有气泡但未出现浑浊.其可能原因是温度升高,CO2被H2还原为CO
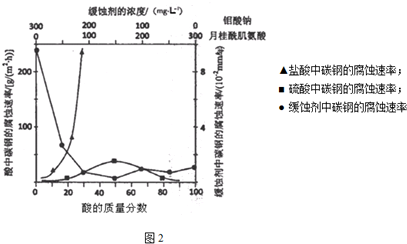
(5)据报道纳米铁粉可用于还原净化含对氯硝基苯的工业污水,同时生成污染性小的对氯苯胺和FeCI2.处理1L该工业污水时,对氯硝基苯去除百分率与加入不同质量纳米铁粉关系如图2甲;加入足量纳米铁粉,对氧硝基苯去除速率与pH的关系如图2乙.
①综合考虑纳米铁的利用率及去除效率,处理同样1L污水加入纳米铁粉最佳为1.0g;
②图乙pH大于6.5时,除去速率变化很快变小的原因可能是PH变大,生成Fe(OH)2覆盖在铁粉表面,阻碍反应进行,反应速率变化很快变小.
分析 (1)根据仪器的构造可知a为蒸馏烧瓶,C中的反应不能有水,浓硫酸的作用即为干燥氢气;
(2)打开分液漏斗活塞,用产生的氢气排出体系内的空气,一段时间后再对C装置加热,这样操作的目的是防止干拢实验,防止爆炸;根据反应一段时间后D中变蓝,E中溶液变浑浊,C中发生反应是氢气还原FeCO3生成铁、二氧化碳和水书写;
(3)通过调节分液漏斗活塞来减缓硫酸滴加速度;
(4)将酒精灯换成酒精喷灯,D中变蓝,E中有气泡但未出现浑浊,说明产生了水和一氧化碳,可能是温度过高二氧化碳和氢气反应生成了CO;
(5)①根据图象,从反应的速率和对氯硝基苯去除百分率分析;
②当PH变大后,溶液呈碱性,会使二价铁离子沉淀为Fe(OH)2,覆盖在铁粉表面,阻碍反应进行.
解答 解:(1)从仪器的构造可知a为蒸馏烧瓶,A中制备氢气,用氢气还原C中的铁,氢气必须干燥,浓硫酸的作用即为干燥氢气,
故答案为:蒸馏烧瓶;干燥氢气;
(2)打开分液漏斗活塞,用产生的氢气排出体系内的空气,一段时间后再对C装置加热,这样操作的目的是防止干拢实验,防止爆炸;反应一段时间后D中变蓝,E中溶液变浑浊,C中发生反应是氢气还原FeCO3生成铁、二氧化碳和水,化学方程式是FeCO3+H2=Fe+CO2+H2O,
故答案为:排出体系内的空气,防止干拢实验,防止爆炸;FeCO3+H2$\frac{\underline{\;\;△\;\;}}{\;}$Fe+CO2+H2O;
(3)反应中若观察到B装置中气泡产生过快,通过调节A中分液漏斗活塞,减缓硫酸滴加速度,
故答案为:调节A中分液漏斗活塞,减缓硫酸滴加速度;
(4)将酒精灯换成酒精喷灯,D中变蓝,E中有气泡但未出现浑浊,说明产生了水和一氧化碳,可能是温度过高二氧化碳和氢气反应生成了CO,
故答案为:温度升高,CO2被H2还原为CO;
(5)①根据图象,在相同时间内,加入米铁粉为1.0g时,反应的速率比较快,且对氯硝基苯去除百分率比较高,而加入1.2g时当随着时间推移,去除率变化不大,速率与1.0相差不大,但是原料的费用高,加入0.8g时,速率慢、去除率低,故最佳为1.0g,
故答案为:1.0;
②当PH变大后,溶液呈碱性,会使二价铁离子沉淀为Fe(OH)2,覆盖在铁粉表面,阻碍反应进行,反应速率变化很快变小,
故答案为:PH变大,生成Fe(OH)2覆盖在铁粉表面,阻碍反应进行,反应速率变化很快变小.
点评 本题考查了用氢气和碳酸亚铁制取纳米级铁粉,涉及到实验仪器装置的使用,物质性质的考查,反应速率的影响条件比较等广泛内容,需要对知识的全面掌握,理清实验原理,难度中等.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 816O、817O、818O互为同素异形体 | |
| B. | 正戊烷、异戊烷、新戊烷互为同系物 | |
| C. | O2与O3互为同位素 | |
| D. | CH3-CH2-OH与CH3-O-CH3互为同分异构体 |
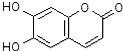
| A. | M的相对分子质量是172 | |
| B. | 1mol M最多能与3mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1mol M与足量Na反应能生成1mol H2 |
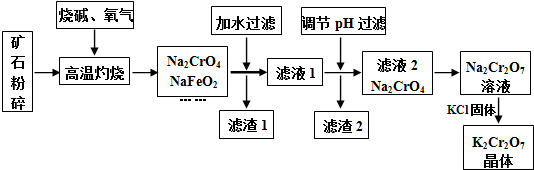
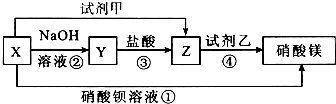
已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
 ③
③ .
.