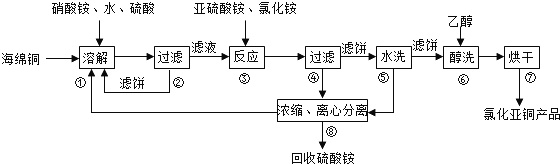
题目内容
4.设NA代表阿伏加德罗常数,下列说法正确的是( )| A. | 56g金属铁完全反应时失去的电子数为一定为2NA | |
| B. | 18g水所含的电子数目为NA | |
| C. | 在常温常压下,48g氧气和臭氧的混合气体所含的原子数目为3NA | |
| D. | 在常温常压下,11.2L二氧化硫所含的分子数目为0.5 NA |
分析 A、铁反应后可能变为+2价,还可能变为+3价;
B、求出水的物质的量,然后根据水含10个电子来分析;
C、氧气和臭氧均由氧原子构成;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、铁反应后可能变为+2价,还可能变为+3价,故56g铁即1mol铁失去电子可能为2NA个,还可能为3NA个,故A错误;
B、18g水的物质的量为1mol,而水含10个电子,故1mol水中含10NA个电子,故B错误;
C、氧气和臭氧均由氧原子构成,故48g混合物中含有的氧原子的物质的量为3mol,则含3NA个原子,故C正确;
D、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L二氧化硫的物质的量小于0.5mol,则分子个数小于0.5NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
15.下列关于溶液物质的量浓度的说法正确的是( )
| A. | 标准状况下,将22.4LHCl溶于1L水,可配成1mol•L-l的稀盐酸 | |
| B. | 将100mL18mol•L-1的浓H2SO4和100mL水混合,可配成9moI•L-l的H2SO4溶液 | |
| C. | 将4.0gNaOH溶于100mL容量瓶中,加水至刻度线,配成1mol•L-1的NaOH溶液 | |
| D. | 将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1mol•L-1 |
12.现有200ml.含KNO3和Cu(NO3)2的混合溶液,其中c(NO3- )=3mol•L-l,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况).假定电解后溶液体积仍为200ml),下列说法不正确的是( )
| A. | 电解过程中共转移0.4 mol电子 | B. | 原混合液中c(K+)为2.0 mol•L-l | ||
| C. | 电解得到的Cu的质量为6.4 g | D. | 电解后溶液中c(H+)为0.1 mol•L-l |
19.下列物质分类正确的是( )
| A. | CuO、Na2O和Na2O2都是碱性氧化物 | |
| B. | SO2能与碱反应生成盐和水,因此SO2属于酸性氧化物 | |
| C. | NH4Cl不含金属阳离子,不属于盐 | |
| D. | 金属氧化物都是碱性氧化物 |
9.电动自行车给人们带来了极大的方便,其电池为铅蓄电池,PbO2作为铅蓄电池的重要原料有广泛的用途.己知:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O,下列说法正确的是( )
| A. | PbO2为还原剂,具有还原性 | |
| B. | 氧化产物与还原产物的物质的量之比为5:2 | |
| C. | 生成1mol的Pb2+,转移的电子的物质的量为2mol | |
| D. | 酸性环境下MnO4-具有强氧化性,其氧化性强于PbO2 |
16.质量相同的下列物质中,含分子数最多的是( )
| A. | O3 | B. | CO | C. | Cl2 | D. | NH3 |
13.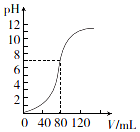 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.