题目内容
15.下列关于溶液物质的量浓度的说法正确的是( )| A. | 标准状况下,将22.4LHCl溶于1L水,可配成1mol•L-l的稀盐酸 | |
| B. | 将100mL18mol•L-1的浓H2SO4和100mL水混合,可配成9moI•L-l的H2SO4溶液 | |
| C. | 将4.0gNaOH溶于100mL容量瓶中,加水至刻度线,配成1mol•L-1的NaOH溶液 | |
| D. | 将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1mol•L-1 |
分析 A.标况下,22.4LHCl的物质的量是1mol,1molHCl溶于1L水,溶于体积大于1L,根据c=$\frac{n}{V}$判断;
B.浓硫酸密度大于水,100mL浓硫酸和100mL水混合后溶液体积小于200mL;
C.容量瓶只能用来配制一定物质的量浓度溶液,不能溶解、稀释药品,NaOH溶于水放热,溶液有热胀冷缩性质;
D.溶液浓度具有均一性,溶液浓度与体积大小无关.
解答 解:A.标况下,22.4LHCl的物质的量是1mol,1molHCl溶于1L水,溶于体积大于1L,根据c=$\frac{n}{V}$知,溶液浓度小于1mol/L,故A错误;
B.浓硫酸密度大于水,100mL浓硫酸和100mL水混合后溶液体积小于200mL,则二者混合后溶液物质的量浓度大于9mol/L,故B错误;
C.容量瓶只能用来配制一定物质的量浓度溶液,不能溶解、稀释药品,NaOH溶于水放热,溶液有热胀冷缩性质,将4.0gNaOH溶于100mL容量瓶中,加水至刻度线,冷却至室温后溶液体积小于100mL,则配成的NaOH溶液浓度大于1mol/L,故C错误;
D.溶液浓度具有均一性,溶液浓度与体积大小无关,所以将0.1molNaCl配成100mL溶液,从中取出10mL,所取出溶液的物质的量浓度为1mol•L-1,故D正确;
故选D.
点评 本题考查物质的量浓度有关计算,为高频考点,侧重考查学生分析判断、计算能力,正确理解c=$\frac{n}{V}$中各个字母含义是解本题关键,易错选项是C.

练习册系列答案
相关题目
5.食醋总酸量的测定
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(CH3COOH,g/100mL).
(一)、实验用品:市售食用白醋样品500mL(商标注明:总酸量:3.5g-5g/100mL)(下称“原醋”),0.1000mol/LNaOH标准溶液,蒸馏水,0.1%甲基橙溶液、0.1%酚酞溶液;仪器自选.
(二)、实验原理:化学方程式CH3COOH+NaOH=CH3COONa+H2O
(三)、实验步骤:
(1)配制待测食醋溶液
准确量取10.00mL原醋,配制成100.00mL待测食醋溶液(下称“待测液”).完成该步骤,需要的一种定量仪器是100ml容量瓶(填仪器名称)
(2)量取一定体积的待测液
用酸式滴定管取20.00mL待测液于锥形瓶中.加1-2滴0.1%酚酞溶液做指示剂
(3)盛装标准NaOH溶液,记录为NaOH标准溶液体积的初读数.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内溶液颜色变化直到滴定终点.判断滴定终点的现象是由无色变为浅红色,半分钟内不褪色.
记录NaOH的终读数.重复滴定4次.
(四)、实验记录及数据处理(请完成相关填空)
(5)四次实验中明显有误差的一次是4(填编号).
(6)消耗NaOH溶液的平均值是15.00mL.
(7)待测液的浓度是0.075mol/L.
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(CH3COOH,g/100mL).
(一)、实验用品:市售食用白醋样品500mL(商标注明:总酸量:3.5g-5g/100mL)(下称“原醋”),0.1000mol/LNaOH标准溶液,蒸馏水,0.1%甲基橙溶液、0.1%酚酞溶液;仪器自选.
(二)、实验原理:化学方程式CH3COOH+NaOH=CH3COONa+H2O
(三)、实验步骤:
(1)配制待测食醋溶液
准确量取10.00mL原醋,配制成100.00mL待测食醋溶液(下称“待测液”).完成该步骤,需要的一种定量仪器是100ml容量瓶(填仪器名称)
(2)量取一定体积的待测液
用酸式滴定管取20.00mL待测液于锥形瓶中.加1-2滴0.1%酚酞溶液做指示剂
(3)盛装标准NaOH溶液,记录为NaOH标准溶液体积的初读数.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内溶液颜色变化直到滴定终点.判断滴定终点的现象是由无色变为浅红色,半分钟内不褪色.
记录NaOH的终读数.重复滴定4次.
(四)、实验记录及数据处理(请完成相关填空)
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(待测液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.95 | 15.20 | 15.15 | 16.95 |
| V(NaOH)/mL(消耗) | 14.95 | 15.00 | 15.05 | 16.95 |
(6)消耗NaOH溶液的平均值是15.00mL.
(7)待测液的浓度是0.075mol/L.
6.做化学实验时,必须十分重视实验安全.下列有关实验操作不符合上述要求的是( )
| A. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| B. | 加热灼烧后的坩锅放置在实验桌上冷却至室温 | |
| C. | 若不小心打翻酒精灯使酒精着火时,应用湿抹布盖灭 | |
| D. | 蒸馏操作过程中,若发现忘加沸石,应立即停止加热,待烧瓶冷却后再加入沸石 |
3.下列说法正确的是( )
| A. | 放热反应在常温下都很容易发生 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 根据反应物和生成物具有总能量的相对大小可确定反应热 |
10.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| C. | 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA | |
| D. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA |
20.下列物质中,属于纯净物的是( )
| A. | 明矾 | B. | 铝热剂 | C. | 赤铁矿 | D. | 不锈钢 |
7. 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
 用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升.根据实验现象判断下列说法错误的是( )| A. | 实验中发生的反应都是化合反应 | B. | 铝是一种较活泼的金属 | ||
| C. | 铝与氧气反应放出大量的热量 | D. | 铝片上生成的白毛是氧化铝 |
4.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 56g金属铁完全反应时失去的电子数为一定为2NA | |
| B. | 18g水所含的电子数目为NA | |
| C. | 在常温常压下,48g氧气和臭氧的混合气体所含的原子数目为3NA | |
| D. | 在常温常压下,11.2L二氧化硫所含的分子数目为0.5 NA |
10.亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
1测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).NaNO2溶液中c(HNO2)=c(OH-)-c(H+)(用溶液中其它离子的浓度关系式表示).
2沉淀法
取2mL0.1mol/L两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液.两支试管均产生白色沉淀.分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.该温度下 Ksp(AgNO2)=2×10-8;
Ksp(AgCl)=1.8×10-10则反应AgNO2(s)+Cl-(aq)?AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{1000}{9}$(计算结果写成分数)
(二)实验室可用如下装置(略去部分夹持仪器)制备亚硝酸钠.
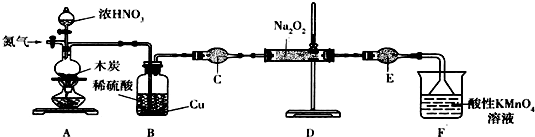
已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3$\frac{\underline{\;加热\;}}{\;}$CO2+4NO2+2H2O.装置B 的作用是将NO2 气体转变为NO,为后面反应提供原料.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(三)测定亚硝酸钠的含量
称取4.000g制取样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一组实验数据出现异常,造成这种异常的原因可能是ac(填代号).
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O
③根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.(结果保留两位小数)
㈠鉴别NaCl和NaNO2
1测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O?HNO2+OH-(用离子方程式解释).NaNO2溶液中c(HNO2)=c(OH-)-c(H+)(用溶液中其它离子的浓度关系式表示).
2沉淀法
取2mL0.1mol/L两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液.两支试管均产生白色沉淀.分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.该温度下 Ksp(AgNO2)=2×10-8;
Ksp(AgCl)=1.8×10-10则反应AgNO2(s)+Cl-(aq)?AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{1000}{9}$(计算结果写成分数)
(二)实验室可用如下装置(略去部分夹持仪器)制备亚硝酸钠.

已知:①2NO+Na2O2═2NaNO2;
②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(1)加热装置A前,先通一段时间N2,目的是排出装置中的空气.
(2)装置A中发生反应的化学方程式为C+4HNO3$\frac{\underline{\;加热\;}}{\;}$CO2+4NO2+2H2O.装置B 的作用是将NO2 气体转变为NO,为后面反应提供原料.
(3)仪器C的名称为干燥管,其中盛放的药品为碱石灰(填名称).
(三)测定亚硝酸钠的含量
称取4.000g制取样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol•L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 次数 | 2 | 3 | ||
| KMnO体积/m | 20.60 | 20.02 | 20.00 | 9.98 |
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式6H++2MnO4-+5NO2-=2Mn2++5NO3-+3H2O
③根据表中数据,计算所得固体中亚硝酸钠的质量分数86.25%.(结果保留两位小数)