题目内容
14. 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.(1)图象中T1和T2的关系是T1>T2(填“>”、“<”或“=”);
(2)比较a、b、c三点所处的平衡状态中,反应物NO2的转化率最大的是c(填字母);
(3)若起始时NO2是4mol,容器体积为1L,n=1mol,NO2的转化率为50%,则此条件下(T2),反应的平衡常数为0.125或1/8.
分析 (1)根据温度对化学平衡的影响,温度升高,平衡向吸热方向移动;
(2)增加反应物的浓度(氧气),平衡正向移动;
(3)根据三段式计算平衡时各组分的浓度,由化学平衡常数k的概念计算.
解答 解:(1)该反应是放热反应,升高温度,平衡向吸热方向移动,即逆向移动,五氧化二氮的含量降低,T1的五氧化二氮的含量比T2的低,所以,T1>T2.
故答案为:>
(2)abc为该反应在T2时的状态,b点代表平衡状态,c点又加入了氧气,故平衡向右移动,NO2的转化率增大;
故答案为:c
(3)根据三段式得平衡时各组分的平衡浓度:
4NO2(g)+O2(g)?2N2O5(g)
起始浓度:4mol/L 1mol/L 0mol/L
转化浓度:2mol/L 0.5mol/L 1mol/L
平衡浓度:2mol/L 0.5mol/L 1mol/L
平衡常数K=$\frac{{1}^{2}}{{2}^{4}×0.5}$=0.125,
故答案为:0.125.
点评 本题考查了外界条件对反应速率和平衡的影响、平衡的判断等,题目难度中等,注重高考常考点的考查,注意图象中数据的分析.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
4.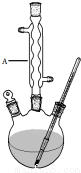 水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为
水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为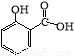 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
请根据以上信息回答下列问题:
(1)仪器A的名称是球形冷凝管.
(2)实验中加入甲苯对合成水杨酸甲酯的作用是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)实验中加入无水硫酸镁的作用是干燥剂.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(填操作名称).
(5)本实验的产率为60%.
 水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为
水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(结构简式为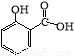 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
Ⅰ.如图,在三颈烧瓶中加入13.8g (0.1mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯9.12g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管.
(2)实验中加入甲苯对合成水杨酸甲酯的作用是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)实验中加入无水硫酸镁的作用是干燥剂.
(4)反应结束后,分离出甲醇采用的方法是蒸馏(填操作名称).
(5)本实验的产率为60%.
5.食醋总酸量的测定
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(CH3COOH,g/100mL).
(一)、实验用品:市售食用白醋样品500mL(商标注明:总酸量:3.5g-5g/100mL)(下称“原醋”),0.1000mol/LNaOH标准溶液,蒸馏水,0.1%甲基橙溶液、0.1%酚酞溶液;仪器自选.
(二)、实验原理:化学方程式CH3COOH+NaOH=CH3COONa+H2O
(三)、实验步骤:
(1)配制待测食醋溶液
准确量取10.00mL原醋,配制成100.00mL待测食醋溶液(下称“待测液”).完成该步骤,需要的一种定量仪器是100ml容量瓶(填仪器名称)
(2)量取一定体积的待测液
用酸式滴定管取20.00mL待测液于锥形瓶中.加1-2滴0.1%酚酞溶液做指示剂
(3)盛装标准NaOH溶液,记录为NaOH标准溶液体积的初读数.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内溶液颜色变化直到滴定终点.判断滴定终点的现象是由无色变为浅红色,半分钟内不褪色.
记录NaOH的终读数.重复滴定4次.
(四)、实验记录及数据处理(请完成相关填空)
(5)四次实验中明显有误差的一次是4(填编号).
(6)消耗NaOH溶液的平均值是15.00mL.
(7)待测液的浓度是0.075mol/L.
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(CH3COOH,g/100mL).
(一)、实验用品:市售食用白醋样品500mL(商标注明:总酸量:3.5g-5g/100mL)(下称“原醋”),0.1000mol/LNaOH标准溶液,蒸馏水,0.1%甲基橙溶液、0.1%酚酞溶液;仪器自选.
(二)、实验原理:化学方程式CH3COOH+NaOH=CH3COONa+H2O
(三)、实验步骤:
(1)配制待测食醋溶液
准确量取10.00mL原醋,配制成100.00mL待测食醋溶液(下称“待测液”).完成该步骤,需要的一种定量仪器是100ml容量瓶(填仪器名称)
(2)量取一定体积的待测液
用酸式滴定管取20.00mL待测液于锥形瓶中.加1-2滴0.1%酚酞溶液做指示剂
(3)盛装标准NaOH溶液,记录为NaOH标准溶液体积的初读数.
(4)滴定操作:滴定时一手控制滴定管,一手摇动锥形瓶,眼睛观察锥形瓶内溶液颜色变化直到滴定终点.判断滴定终点的现象是由无色变为浅红色,半分钟内不褪色.
记录NaOH的终读数.重复滴定4次.
(四)、实验记录及数据处理(请完成相关填空)
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(待测液)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(终读数) | 14.95 | 15.20 | 15.15 | 16.95 |
| V(NaOH)/mL(消耗) | 14.95 | 15.00 | 15.05 | 16.95 |
(6)消耗NaOH溶液的平均值是15.00mL.
(7)待测液的浓度是0.075mol/L.
2. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管,该实验最佳应选用酚酞作指示剂,达到滴定终点的实验现象是:锥形瓶由无色变为浅红色且半分钟内不复原.
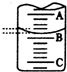
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体 积大于24.60ml.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是CD.
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水洗涤,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=$\frac{c×(25.35+25.30)}{2V}$mol/L.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室中用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体 积大于24.60ml.
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
A.实验结束时俯视滴定管中液面,读取滴定终点时NaOH溶液的体积
B.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.盛装标准液的滴定管装液前用蒸馏水洗涤,未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):c(CH3COOH)=$\frac{c×(25.35+25.30)}{2V}$mol/L.
6.做化学实验时,必须十分重视实验安全.下列有关实验操作不符合上述要求的是( )
| A. | 在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度 | |
| B. | 加热灼烧后的坩锅放置在实验桌上冷却至室温 | |
| C. | 若不小心打翻酒精灯使酒精着火时,应用湿抹布盖灭 | |
| D. | 蒸馏操作过程中,若发现忘加沸石,应立即停止加热,待烧瓶冷却后再加入沸石 |
3.下列说法正确的是( )
| A. | 放热反应在常温下都很容易发生 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 需要加热才能发生的反应都是吸热反应 | |
| D. | 根据反应物和生成物具有总能量的相对大小可确定反应热 |
4.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 56g金属铁完全反应时失去的电子数为一定为2NA | |
| B. | 18g水所含的电子数目为NA | |
| C. | 在常温常压下,48g氧气和臭氧的混合气体所含的原子数目为3NA | |
| D. | 在常温常压下,11.2L二氧化硫所含的分子数目为0.5 NA |
 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.