题目内容
18.在一密闭容器中有CH4和O2混合气体共20g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是( )| A. | 80% | B. | 60% | C. | 40% | D. | 33.3% |
分析 CH4和O2混合气体放入足量Na2O2用电火花引燃,生成二氧化碳、水与过氧化钠反应:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体中2CH4和O2的质量和,据此计算.
解答 解:CH4和O2混合气体放入足量Na2O2用电火花引燃,生成二氧化碳、水与过氧化钠反应:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体中2CH4和O2的质量和,则甲烷的质量为:8g×$\frac{16×2}{16×2+32}$=4g,所以混合中O2的质量分数是$\frac{20g-4g}{20g}×100%$=80%,故选A.
点评 本题考查混合物的计算,题目难度中等,关键在于根据反应方程式判断过氧化钠固体质量增加实质为氢气与甲醛的质量.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
10.下列有关物质应用的说法正确的是( )
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去油脂 | |
| B. | 硝酸与铁发生化学反应,不可用铁制容器盛装浓硝酸 | |
| C. | 铝表面易形成致密的氧化膜,铝制器皿可长时间盛放咸菜等腌制食品 | |
| D. | H2与Cl2光照发生爆炸,工业上不能用H2与Cl2做原料生产HCl |
11.在标准状况下,下列各组气体混合后,所得气体的平均摩尔质量可能为40g•mol-1的是( )
| A. | Cl2和HCl | B. | N2和O2 | C. | SO2和CO2 | D. | CO2和O2 |
6.下列离子方程式正确的是( )
| A. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合:2NH4++Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+AlO2-+3BaSO4↓+2H2O | |
| B. | 将含有等物质的量溶质的NaHCO3溶液和Ba(OH)2溶液混合:Ba2++HCO${\;}_{3}^{-}$+OH-═BaCO3↓+H2O | |
| C. | 在重铬酸钾溶液中,加酸后溶液变为黄色:Cr2O72-+H2O═2 CrO42-+2H+ | |
| D. | 过量氯水与FeI2溶液作用:2Fe2++2I-+2Cl2═2 Fe3++I2+4Cl- |
13.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3═bO2↑+cCl2↑+dHClO4+eH2O.下列有关说法正确的是( )
| A. | 由反应可确定:氧化产物是O2 | |
| B. | 若氯酸分解所得混合气体lmol混合气体质量为45g,则反应方程式可表示为:3HClO3═2O2↑+C12↑+HClO4+H2O | |
| C. | 由非金属性Cl>S,可推知酸性HClO3>H2SO4 | |
| D. | 若化学计量数a=8,b=3,则该反应转移电子数为8e- |
10.下列卤代烃中,既能发生消去反应又能发生水解反应的是( )
| A. |  | B. |  | C. | CH3CHBrCH3 | D. |  |
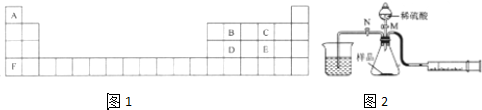
7. X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的最常见气态氢化物的水溶液显碱性 | |
| B. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| C. | Z的单质与氢气反应比Y单质与氢气反应剧烈 | |
| D. | X、W的气态氢化物相互反应,生成物中只含离子键不含共价键 |