题目内容
6.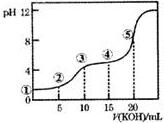 常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )
常温下,用0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液所得滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)/c(OH-)=1012 | |
| B. | 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| C. | 点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | |
| D. | 点⑤所示溶液中:c(OH-)=c(H+)+c(HC2O4-)+c(H2C2O4) |
分析 A.H2C2O4为弱酸在溶液中部分电离,c(H+)<0.1mol/L;
B.H2C2O4与KOH恰好反应生成KHC2O4,溶液显酸性,说明HC2O4-的电离程度大于水解程度;
C.根据物料守恒分析;
D.氢氧化钾的物质的量是草酸的2倍,二者恰好反应而溶液呈碱性,说明草酸是二元弱酸,根据质子守恒判断.
解答 解:A.点①所示溶液中溶质为H2C2O4,H2C2O4为弱酸在溶液中部分电离,c(H+)<0.1mol/L,所以c(H+)/c(OH-)<1012,故A错误;
B.③H2C2O4与KOH恰好反应生成KHC2O4,溶液显酸性,说明HC2O4-的电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),所以c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故B错误;
C.0.10mol•L-1的KOH标准溶液滴定10.00mL0.10mol•L-1的H2C2O4(二元弱酸)溶液,由物料守恒可知,c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.1mol•L-1,故C正确;
D.⑤点时,氢氧化钾的物质的量是草酸的2倍,二者恰好反应生成草酸钠,根据质子守恒得c(H+)+c(C2O4 2- )+2c(H2C2O4)=c(OH-),故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,明确各点溶液中溶质及其性质是解本题关键,会根据溶液酸碱性确定水解和电离程度相对大小,题目难度中等.

练习册系列答案
相关题目
16.化学与生活息息相关,下列说法错误的是( )
| A. | 服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 | |
| B. | 海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等 | |
| C. | 漂白粉长期暴露在空气中会变质失效 | |
| D. | 煤炭燃烧过程安装固硫装置,可有效提高煤的利用率 |
14.下列物质分类错误的是( )
| A. | 同系物:乙酸、软脂酸、硬脂酸 | B. | 同位素:氕、氘、氚 | ||
| C. | 同素异形体:金刚石、石墨、足球烯 | D. | 同分异构体:蔗糖、麦芽糖、葡萄糖 |
1.化学和科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 节日焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 生活中常用的塑料制品及橡胶制品都为高分子材料 | |
| C. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
11.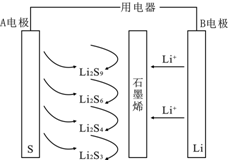 石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
 石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )
石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为2Li+nS=Li2Sn,有关该电池说法正确的是( )| A. | 放电时,Li+向负极迁移 | |
| B. | A电极上发生的一个电极反应为:2Li++6S+2e-=Li2S6 | |
| C. | 若对该电池充电,B电极接电源正极 | |
| D. | B电极发生还原反应 |
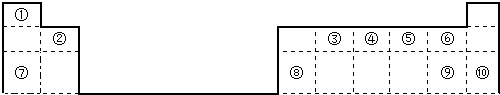
20.下表是现行的元素周期表,请按题中要求回答下列有关问题:
(1)115号元素X的位置第七周期第ⅤA族
(2)画出⑨的简单离子的结构示意图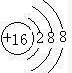 .
.
(3)①②⑤⑧的原子半径由大到小的顺序是Na>Si>C>H(用元素符号表示).
(4)②⑧⑨⑩的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3>H2SiO3(用化学式表示).
(5)⑤与⑦的最高价氧化物的水化物间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑨⑩的简单离子半径由大到小的顺序是S2->Cl-(用离子符号表示).
(7)⑩的非金属性比⑫强,用一个离子方程式表示为2Br-+Cl2=2Cl-+Br2.
(8)用电子式表示⑨与⑪形成化合物的过程为 .
.
(9)③的气态氢化物与其最高价含氧酸反应的产物中化学键的类型是离子键和共价键.
(10)⑥与⑦的金属性较强的是镁(填元素名称).
(11)②的最高价氧化物的电子式为 .
.
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||
| ⑪ | ⑫ | ||||||||||||||||
(2)画出⑨的简单离子的结构示意图
 .
.(3)①②⑤⑧的原子半径由大到小的顺序是Na>Si>C>H(用元素符号表示).
(4)②⑧⑨⑩的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3>H2SiO3(用化学式表示).
(5)⑤与⑦的最高价氧化物的水化物间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑨⑩的简单离子半径由大到小的顺序是S2->Cl-(用离子符号表示).
(7)⑩的非金属性比⑫强,用一个离子方程式表示为2Br-+Cl2=2Cl-+Br2.
(8)用电子式表示⑨与⑪形成化合物的过程为
 .
.(9)③的气态氢化物与其最高价含氧酸反应的产物中化学键的类型是离子键和共价键.
(10)⑥与⑦的金属性较强的是镁(填元素名称).
(11)②的最高价氧化物的电子式为
 .
. 



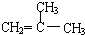 .
.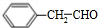 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.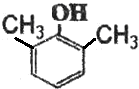 (或
(或 、
、 ).
). ,B的结构简式
,B的结构简式 或
或 .
. ,反应类型:取代反应.
,反应类型:取代反应.