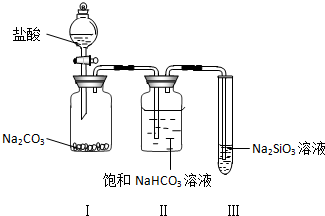
题目内容
11.将0.1mol/L的NaHC2O4溶液与0.1mol/L的NaOH溶液等体积混合后,关于该混合溶液说法不正确的是( )| A. | 该混合溶液中有:c(Na+)+c(H+)=c(HC2O4-)+c (OH-)+2 c (C2O42-) | |
| B. | 该混合溶液中有:c (Na+)=2 (c(HC2O4-)+c (H2C2O4)+c (C2O42-)) | |
| C. | 该混合溶液中有:c (OH-)-c(H+)=c(HC2O4-)+2 c (H2C2O4) | |
| D. | 该混合溶液中有:c (Na+)>c (C2O42-)>c(HC2O4-)>c (OH-)>c(H+) |
分析 将0.1mol/L的NaHC2O4溶液与0.1mol/L的NaOH溶液等体积混合后,二者恰好完全反应生成0.05mol/L的 Na2C2O4,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答 解:将0.1mol/L的NaHC2O4溶液与0.1mol/L的NaOH溶液等体积混合后,二者恰好完全反应生成0.05mol/L的 Na2C2O4,
A.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HC2O4-)+c (OH-)+2 c (C2O42-),故A正确;
B.溶液中存在物料守恒,根据物料守恒得c (Na+)=2[c(HC2O4-)+c(H2C2O4)+c(C2O42-)],故B正确;
C.电荷守恒得c(Na+)+c(H+)=c(HC2O4-)+c (OH-)+2 c (C2O42-),根据物料守恒得c (Na+)=2[c(HC2O4-)+c(H2C2O4)+c(C2O42-)],所以得c (OH-)-c(H+)=c(HC2O4-)+2 c (H2C2O4),故C正确;
D.钠离子不水解、草酸根离子水解但水解程度较小,草酸根离子两步水解都生成氢氧根离子,所以溶液中离子浓度大小顺序是c (Na+)>c (C2O42-)>c (OH-)>c(HC2O4-)>c(H+),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确溶液中溶质成分及其性质是解本题关键,任何电解质溶液中都存在电荷守恒、物料守恒,注意守恒思想的灵活运用,题目难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
6.CO、H2、CH3OH均是清洁能源,一定条件下存在如下转化:
CO(g)+2H2(g)?CH3OH(g)△H
(1)上述物质的有关化学键的键能(单位:kJ•mol-1)数据如下
C≡0:1076,H-H:436,C-H:408,C-O:351,O-H:463;
①上述生成CH3OH的反应的△H=-90kJ/mol.
②若2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,一定条件下,CH3OH(g)可进一步转化为CH30CH3(g)与H2O(g),试写出对应的热化学方程式:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol.
(2)分别向a、b、c三个容积相同的恒容密封容器中冲入10molCO与20molH2,在适当条件下发生反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中H2的浓度(mol•L-1)随时间(min)的变化如图中a、b、c曲线所示.
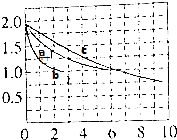
①b容器中的反应在3min时达到平衡,则b容器中v(CO)=$\frac{1}{6}$mol/(L.min).
②容器a、b中的反应条件的差异是b中使用催化剂,若a、c容器中的反应温度不同,则温度较低的容器是b(选填a或c).
③a容器中反应的平衡常数=1,三个容器中平衡常数相对大小关系为c>a=b.
为了寻找合成甲醇的适宜温度和压强,某科研小组设计了三组实验,部分实验数据如下表所示.
则x=160,y=$\frac{2}{3}$.
CO(g)+2H2(g)?CH3OH(g)△H
(1)上述物质的有关化学键的键能(单位:kJ•mol-1)数据如下
C≡0:1076,H-H:436,C-H:408,C-O:351,O-H:463;
①上述生成CH3OH的反应的△H=-90kJ/mol.
②若2CO(g)+4H2(g)═CH3OCH3(g)+H2O(g)△H=-204.7kJ•mol-1,一定条件下,CH3OH(g)可进一步转化为CH30CH3(g)与H2O(g),试写出对应的热化学方程式:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-24.7kJ/mol.
(2)分别向a、b、c三个容积相同的恒容密封容器中冲入10molCO与20molH2,在适当条件下发生反应CO(g)+2H2(g)?CH3OH(g)△H,反应过程中H2的浓度(mol•L-1)随时间(min)的变化如图中a、b、c曲线所示.

①b容器中的反应在3min时达到平衡,则b容器中v(CO)=$\frac{1}{6}$mol/(L.min).
②容器a、b中的反应条件的差异是b中使用催化剂,若a、c容器中的反应温度不同,则温度较低的容器是b(选填a或c).
③a容器中反应的平衡常数=1,三个容器中平衡常数相对大小关系为c>a=b.
为了寻找合成甲醇的适宜温度和压强,某科研小组设计了三组实验,部分实验数据如下表所示.
| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| ① | 160 | $\frac{2}{3}$ | 1 |
| ② | x | $\frac{2}{3}$ | 5 |
| ③ | 260 | y | 5 |
16.下列不属于同种物质的是( )
| A. |  和 和 | B. |  和 和 | ||
| C. |  和CH2═CH-CH2Cl 和CH2═CH-CH2Cl | D. |  和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
20.下表是现行的元素周期表,请按题中要求回答下列有关问题:
(1)115号元素X的位置第七周期第ⅤA族
(2)画出⑨的简单离子的结构示意图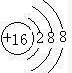 .
.
(3)①②⑤⑧的原子半径由大到小的顺序是Na>Si>C>H(用元素符号表示).
(4)②⑧⑨⑩的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3>H2SiO3(用化学式表示).
(5)⑤与⑦的最高价氧化物的水化物间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑨⑩的简单离子半径由大到小的顺序是S2->Cl-(用离子符号表示).
(7)⑩的非金属性比⑫强,用一个离子方程式表示为2Br-+Cl2=2Cl-+Br2.
(8)用电子式表示⑨与⑪形成化合物的过程为 .
.
(9)③的气态氢化物与其最高价含氧酸反应的产物中化学键的类型是离子键和共价键.
(10)⑥与⑦的金属性较强的是镁(填元素名称).
(11)②的最高价氧化物的电子式为 .
.
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||||||||
| ⑪ | ⑫ | ||||||||||||||||
(2)画出⑨的简单离子的结构示意图
 .
.(3)①②⑤⑧的原子半径由大到小的顺序是Na>Si>C>H(用元素符号表示).
(4)②⑧⑨⑩的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3>H2SiO3(用化学式表示).
(5)⑤与⑦的最高价氧化物的水化物间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑨⑩的简单离子半径由大到小的顺序是S2->Cl-(用离子符号表示).
(7)⑩的非金属性比⑫强,用一个离子方程式表示为2Br-+Cl2=2Cl-+Br2.
(8)用电子式表示⑨与⑪形成化合物的过程为
 .
.(9)③的气态氢化物与其最高价含氧酸反应的产物中化学键的类型是离子键和共价键.
(10)⑥与⑦的金属性较强的是镁(填元素名称).
(11)②的最高价氧化物的电子式为
 .
.
1.高压下氮气聚合生成高聚氮,其晶体中每个氮原子都通过三个单键与其他氮原子结合并向空间发展构成立体网状结构.已知晶体中N-N键的键能为160KJ/mol,而N≡N的键能为942KJ/mol.则下列说法不正确的是( )
| A. | 键能越大说明化学键越牢固,所构成的物质越稳定 | |
| B. | 高聚氮晶体属于原子晶体 | |
| C. | 该晶体中氮原子数与氮氮键数比为1:3 | |
| D. | 高聚氮可以用作炸药 |



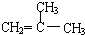 .
.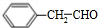 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.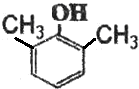 (或
(或 、
、 ).
). ,B的结构简式
,B的结构简式 或
或 .
. ,反应类型:取代反应.
,反应类型:取代反应.