题目内容
1.随着碳原子数的增加,烷烃的溶沸点逐渐升高.对.(判断对错)分析 烃类的沸点与分子间作用力有关,随相对分子质量的增大,分子间作用力增大,沸点升高.
解答 解:烷烃形成的晶体属于分子晶体,随碳原子数增多,相对分子质量增大,分子间作用力增大,溶沸点升高,故答案为:对.
点评 本题考查了烷烃结构和变化的规律分析判断,主要是随碳原子数增大的变化,掌握基础是解题关键,题目较简单.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
9.下列物质中碳元素含量最高的是( )
| A. | 甲烷 | B. | 乙烷 | C. | 乙烯 | D. | 苯 |
16.工业上需要利用一批回收的含铜废料制造胆矾(CuSO4•5H2O).该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质.工艺流程为:
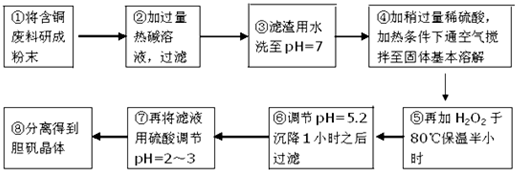
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如表:
请回答下列问题:
(1)步骤①中为什么要将含铜废料研磨成粉状?增大固体反应物的表面积,增大化学反应的速率.
(2)步骤②中的离子方程式(写出2个即可):2Al+2OH-+2H2O=2AlO2-+3H2↑、Si+2OH-+H2O=SiO32-+2H2↑或Al2O3+2OH-=2AlO2-+H2O或SiO2+2OH-=SiO32-+H2O.
(3)步骤⑤中H2O2参加反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)步骤⑥中调节溶液pH时适宜的物质是C、D(填序号).
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是抑制Cu2+的水解,也不会引入杂质.
(6)步骤⑧的分离方法步骤是蒸发浓缩,冷却结晶,过滤,(洗涤、干燥).

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
(1)步骤①中为什么要将含铜废料研磨成粉状?增大固体反应物的表面积,增大化学反应的速率.
(2)步骤②中的离子方程式(写出2个即可):2Al+2OH-+2H2O=2AlO2-+3H2↑、Si+2OH-+H2O=SiO32-+2H2↑或Al2O3+2OH-=2AlO2-+H2O或SiO2+2OH-=SiO32-+H2O.
(3)步骤⑤中H2O2参加反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)步骤⑥中调节溶液pH时适宜的物质是C、D(填序号).
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是抑制Cu2+的水解,也不会引入杂质.
(6)步骤⑧的分离方法步骤是蒸发浓缩,冷却结晶,过滤,(洗涤、干燥).
13.下列说法正确的是( )
| A. | NaCl晶体中每个钠离子与周围6个氯离子形成6个离子键 | |
| B. | 前四周期元素的原子中,未成对电子数最多的是Mn | |
| C. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| D. | 岩浆冷却过程中,晶格能高的矿物晶体先结晶 |
3.下列各组元素性质递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次升高 | |
| B. | P、S、Cl元素最高正化合价依次升高 | |
| C. | B、C、N、O、F原 子半径依次升高 | |
| D. | Li、Na、K的原子半径依次增大 |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: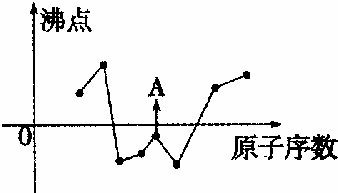

 .
.
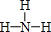 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为 .
.