题目内容
16.工业上需要利用一批回收的含铜废料制造胆矾(CuSO4•5H2O).该废料中各种成份含量如下:Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质.工艺流程为: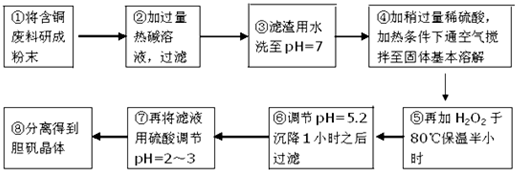
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH如表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 | Fe(OH)2 |
| pH | 5.2 | 3.1 | 6.7 | 9.4 | 9.7 |
(1)步骤①中为什么要将含铜废料研磨成粉状?增大固体反应物的表面积,增大化学反应的速率.
(2)步骤②中的离子方程式(写出2个即可):2Al+2OH-+2H2O=2AlO2-+3H2↑、Si+2OH-+H2O=SiO32-+2H2↑或Al2O3+2OH-=2AlO2-+H2O或SiO2+2OH-=SiO32-+H2O.
(3)步骤⑤中H2O2参加反应的离子方程式:2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)步骤⑥中调节溶液pH时适宜的物质是C、D(填序号).
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Cu(OH)2 E.MgCO3
(5)步骤⑦中用硫酸调节pH=2~3的原因是抑制Cu2+的水解,也不会引入杂质.
(6)步骤⑧的分离方法步骤是蒸发浓缩,冷却结晶,过滤,(洗涤、干燥).
分析 含铜废料制造胆矾(CuSO4•5H2O),Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质,粉碎后加过量热碱溶液,Al、Si及其氧化物能与碱反应生成物溶于水,过滤得到滤渣为Cu、Mg、Fe及其氧化物,还有少量的难溶物质,水洗至PH=7,加稀硫酸、双氧水于80℃保温0.5h,CuO、MgO、FeO都溶于稀硫酸生成硫酸铜、硫酸镁、硫酸亚铁,铜和亚铁离子被双氧水氧化成铜离子和三价铁离子,调至PH=5.2,沉降1小时,三价铁离子沉淀完全,过滤得到滤渣氢氧化铁和滤液,滤液中含有铜离子和镁离子,用硫酸调节溶液pH=2~3,经过对滤液蒸发浓缩、冷却结晶、过滤得到产品,蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质,据此答题.
解答 解:含铜废料制造胆矾(CuSO4•5H2O),Cu和CuO约占87%,其它为Mg、Al、Fe、Si及其氧化物,还有少量的难溶物质,粉碎后加过量热碱溶液,Al、Si及其氧化物能与碱反应生成物溶于水,过滤得到滤渣为Cu、Mg、Fe及其氧化物,还有少量的难溶物质,水洗至PH=7,加稀硫酸、双氧水于80℃保温0.5h,CuO、MgO、FeO都溶于稀硫酸生成硫酸铜、硫酸镁、硫酸亚铁,铜和亚铁离子被双氧水氧化成铜离子和三价铁离子,调至PH=5.2,沉降1小时,三价铁离子沉淀完全,过滤得到滤渣氢氧化铁和滤液,滤液中含有铜离子和镁离子,用硫酸调节溶液pH=2~3,经过对滤液蒸发浓缩、冷却结晶、过滤得到产品,蒸发浓缩时会导致Cu2+发生水解生成Cu(OH)2,用硫酸调节pH=2~3是为了抑制Cu2+的水解,也不会引入杂质,
(1)反应物的接触面积与反应速率成正比,将含铜废料研磨成粉状,增大固体反应物的接触面积,加快了反应速率,
故答案为:增大固体反应物的表面积,增大化学反应的速率;
(2)铝、硅及氧化铝、二氧化硅都能与碱反应,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑; Si+2OH-+H2O=SiO32-+2H2↑;Al2O3+2OH-=2AlO2-+H2O; SiO2+2OH-=SiO32-+H2O,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑; Si+2OH-+H2O=SiO32-+2H2↑或Al2O3+2OH-=2AlO2-+H2O或SiO2+2OH-=SiO32-+H2O;
(3)过氧化氢具有强氧化性,会把亚铁离子氧化为铁离子,本身被还原为水,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)调节pH不能引入新的杂质,A项会引入钠离子,B项会引入铵根离子、E项会引入镁离子,C、D项物质会和氢离子反应调节pH,同时生成铜离子,不会引入新的杂质,
故答案为:C、D;
(4)铜离子为弱碱阳离子能水解,水解方程式为:Cu2++2H2O?Cu(OH)2+2H+,加热时会促进水解,加入硫酸,增大了H+离子浓度,会抑制铜离子水解,
故答案为:抑制Cu2+的水解,也不会引入杂质;
(5)步骤⑧为从溶液中获得硫酸铜晶体,从溶液中得到晶体一般采取蒸发浓缩,冷却结晶,过滤,(洗涤、干燥) 的方法.
故答案为:蒸发浓缩,冷却结晶,过滤,(洗涤、干燥).
点评 本题以流程图的形式考察了物质的分离与提纯、离子方程式的书写、水解平衡等知识.分离和提纯时一定不能引入新的杂质,调节pH一般加入含提纯物质中的离子的化合物,避免引入新的杂质.如本题制取胆矾晶体,用Cu2(OH)2CO3、Cu(OH)2调节pH,除去杂质.

 金钥匙试卷系列答案
金钥匙试卷系列答案| A. |  图表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀的量关系曲线 | |
| B. |  图表示向含有等物质的量的NaOH和Na2CO3溶液中加入盐酸放出CO2的关系曲线 | |
| C. |  图表示向含有等物质的量的NaOH和Ca(OH)2溶液中通入CO2的产生沉淀关系曲线 | |
| D. |  图表示向NaOH溶液中滴加AlCl3溶液产生沉淀的量关系曲线 |
(1)下列描述错误的是acde.
a.为了防止试剂瓶内的试剂被污染,取用后多余的试剂一定都不能放回原试剂瓶
b.滴定管、容量瓶、分液漏斗在使用时都需要检漏
c.海带中碘的提取时需要对干海带进行灼烧,此时需要用到的仪器有玻璃棒、燃烧匙、泥三角、三脚架、酒精灯
d.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入Ba(NO3)2溶液,产生白色沉淀,滴加稀盐酸,观察白色沉淀是否溶解
e.海带中碘的提取时,对碘水中的碘进行萃取可采用裂化汽油、苯、四氯化碳、无水酒精等有机溶剂
(2)某溶液中可能存在Br-、CO32-、SO32-、I-、A13+、Mg2+、Na+等7种离子中的某几种.现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入稀盐酸沉淀不溶解.
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:该溶液肯定存在的离子是:CO32-、Br-、Na+、SO32-
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
| A. | MgCl2晶体 | B. | NaCl溶液 | C. | 液态HCl | D. | 熔融的NaOH |
 ⑪
⑪ ⑫
⑫
 .
.