题目内容
4.如表列出了8种短周期元素在元素周期表中时位置,请用相应的化学用语问答下列问题:
(1)元素⑦在元素周期表中处于第三周期,第ⅥA族.
(2)上述8种元素中,金属性最强的元素的符号为Na,最高价氧化物对应的水化物酸性最强的物质的分子式为HClO4.
(3)元素②、③和⑥分别形成的简单气态氢化物中,稳定性最强的结构式为
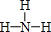 .②的简单气态氢化物的电子式为
.②的简单气态氢化物的电子式为 .
.(4)元素④和⑤各自的最高价氧化物对应的水化物之间反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)由①、⑦和⑧三种元素中的一种或几种组成的单质和化合物两两反应中.能证明元素⑧的非金属性强于⑦的置换反应的化学方程式为H2S+Cl2=S↓+2HCl.
分析 由元素在周期表中位置知,①为H、②为C、③为N,④为Na、⑤为Al、⑥为Si、⑦为S、⑧为Cl.
(1)由元素位置可知,⑦处于第三周期ⅥA族;
(2)同周期自左而右金属性减弱,同主族自上而下金属性增强;最高价氧化物对应的水化物酸性最强的是高氯酸;
(3)②的简单氢化物为CH4;非金属性越强氢化物最稳定,但甲烷比NH3稳定,故三种氢化物中CH4最稳定;
(4)元素④和⑤的最价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水;
(5)由①、⑦和⑧三种元素中的一种或几种组成的单质和化合物两两反应中.能证明元素⑧的非金属性强于⑦的置换反应是氯气与硫化氢反应生成硫与HCl.
解答 解:由元素在周期表中位置知,①为H、②为C、③为N,④为Na、⑤为Al、⑥为Si、⑦为S、⑧为Cl.
(1)由元素位置可知,⑦处于第三周期ⅥA族,故答案为:三;ⅥA;
(2)同周期自左而右金属性减弱,同主族自上而下金属性增强,故上述元素中Na的金属性最强;最高价氧化物对应的水化物酸性最强的是HClO4,
故答案为:Na;HClO4;
(3)②、③和⑥中非金属性N>C>Si,则三种氢化物中NH3最稳定,其结构式为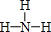 ,②的简单氢化物为CH4,电子式为
,②的简单氢化物为CH4,电子式为 ,
,
故答案为: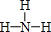 ;
; ;
;
(4)元素④和⑤的最价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)由①、⑦和⑧三种元素中的一种或几种组成的单质和化合物两两反应中.能证明元素⑧的非金属性强于⑦的置换反应是氯气与硫化氢反应生成硫与HCl,反应方程式为:H2S+Cl2=S↓+2HCl,故答案为:H2S+Cl2=S↓+2HCl.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用及反应原理的应用,题目难度不大.

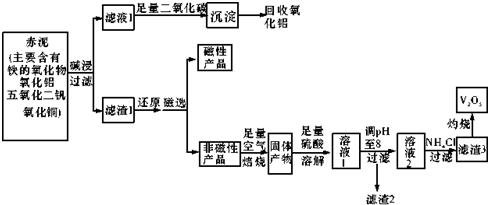
已知:I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以V02+和V03-的形式存在,存在平衡V02++H20?V03-+2H+.
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
(1)碱浸步骤中最好选用a.
a.Na0H溶液b.氨水 c.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3+HCO3-;.
(3)磁选步骤得到的磁性产品为铁.
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使使VO2+转化为VO3-.
(5)滤渣3的主要成分为NH4VO3,工业上常用铝热反应法由V205冶炼金属钒,请写出反应的化学方程式3V205+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al203.
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.17 mol/(L•min) | D. | v(NH3)=0.01 mol/(L•min) |
| 化学键 | H-H | H-Cl | H-Br | CI-CI | Br-Br |
| 键能( KJ•mol-1) | 436 | 431 | 299 | 247 | 193 |
| A. | HCl | B. | HBr | C. | H2 | D. | Br2 |
 .
. .
. .
.