题目内容
7.探究废酸性锌锰干电池内的黑色固体回收利用时,进行了如下图所示实验: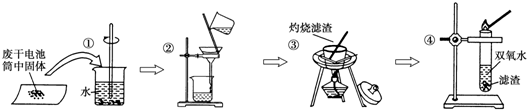
电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质.请回答以下问题:
(1)该电池的正极反应式为MnO2+e-+H+=MnOOH,电池反应的离子方程式为Zn+2MnO2+2H+=Zn2++2MnOOH
(2)操作③中所用到的仪器除了酒精灯、玻璃棒外还有蒸发皿.灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中还存在的物质为C(填化学式).操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定黑色固体为二氧化锰(填名称).
(3)浓硝酸见光易分解,写出浓硝酸分解的化学方程式4HNO3 $\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O;
(4)实验同学收集浓硝酸分解产生的气体于试管中,把带火星的木条插入其中,发现带火星的木条复燃,该同学认为是因为浓硝酸分解产生了氧气.请回答该同学的结论是否正确,并说明原因结论错误,浓硝酸分解产生的气体中,氧气所占比例和空气中的相同,木条能够复燃证明二氧化氮也会助燃支持燃烧.
分析 (1)该原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,负极上锌失电子发生氧化反应,在得失电子相同条件下正负极电极反应式相加即得电池反应式;
(2)操作③是蒸发溶液,需要的仪器是蒸发皿、玻璃棒、酒精灯等,根据固体的颜色和化学性质分析该物质,能使双氧水迅速产生氧气的黑色物质是二氧化锰.
(3)浓硝酸见光易分解生成二氧化氮、氧气和水;
(4)实验同学收集浓硝酸分解产生的气体于试管中,把带火星的木条插入其中,发现带火星的木条复燃,分解生成的二氧化氮和氧气之比与空气中氮气和氧气之比相同,可能是二氧化氮的助燃性.
解答 解:(1)该原电池中,Zn易失电子作负极、二氧化锰作正极,正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H+=MnOOH;负极上锌失电子发生氧化反应,电极反应式为Zn-2e-=Zn2+;在得失电子相同条件下正负极电极反应式相加即得电池反应式,电极反应式为 Zn+2MnO2+2H+=Zn2++2MnOOH;
故答案为:MnO2+e-+H+=MnOOH;Zn-2e-=Zn2+; Zn+2MnO2+2H+=Zn2++2MnOOH.
(2)操作③是蒸发溶液,需要的仪器是蒸发皿、玻璃棒、酒精灯等,操作③中所用到的仪器除了酒精灯、玻璃棒外还有蒸发皿,使澄清石灰水变浑浊的气体有二氧化碳和二氧化硫,二氧化碳可由黑色的碳单质灼烧制得,二氧化硫可由淡黄色的硫单质灼烧制得,所以该黑色物质是碳单质,能使带火星的木条复燃的气体是氧气,能使双氧水迅速产生氧气的黑色固体物质是二氧化锰,
故答案为:蒸发皿;C;二氧化锰;
(3)浓硝酸见光易分解生成二氧化氮、氧气和水,反应的化学方程式为:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O,
故答案为:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O;
(4)实验同学收集浓硝酸分解产生的气体于试管中,把带火星的木条插入其中,发现带火星的木条复燃,分解生成的二氧化氮和氧气之比与空气中氮气和氧气之比相同,可能是二氧化氮的助燃性,所以结论错误,浓硝酸分解产生的气体中,氧气所占比例和空气中的相同,木条能够复燃证明二氧化氮也会助燃支持燃烧,
故答案为:结论错误,浓硝酸分解产生的气体中,氧气所占比例和空气中的相同,木条能够复燃证明二氧化氮也会助燃支持燃烧.
点评 本题考查了基本实验操作及离子的检验,熟悉原电池原理、物质性质和反应产物的判断是解题关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 10 (b-2a) mol•L-1 | B. | 10(2a-b) mol•L-1 | C. | 20(a-2b) mol•L-1 | D. | 20(b-2a) mol•L-1 |
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | 生铁>钠>纯铁 |
| A. | 乙烯的结构简式CH2CH2 | B. | 基态氧原子L层电子排布图: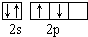 | ||
| C. | CH4分子中只有σ键 | D. | HClO的结构式:H-Cl-O |
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 胆矾 | 干冰 |
| B | 液氨 | 漂白粉 | 硫酸钡 | 二氧化硫 |
| C | 石墨 | 空气 | 苛性钠 | 碳酸钙 |
| D | 浓硫酸 | 氨水 | 氯化钠 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
| A. | Na2CO3 | B. | Na2O2 Na2CO3 | ||
| C. | NaOH Na2CO3 | D. | Na2O2 NaOH Na2CO3 |
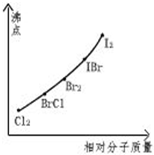 卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题:
卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,xx,型卤素互化物与卤素单质结构相似,性质相近.试回答下列问题: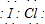 ,写出该物质与NaOH溶液反应的化学方程式2NaOH+ICl═NaCl+NaIO+H2O
,写出该物质与NaOH溶液反应的化学方程式2NaOH+ICl═NaCl+NaIO+H2O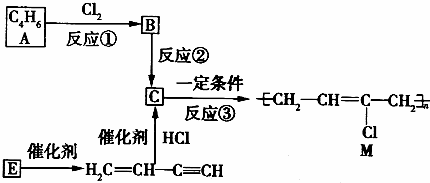
 .
.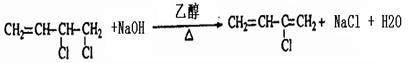 .
. 、
、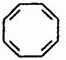 .鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液.
.鉴别这两个环状化合物的试剂为溴水或酸性高锰酸钾溶液.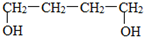 ),其反应步骤为:(第一、三步用化学方程式表示)
),其反应步骤为:(第一、三步用化学方程式表示)