题目内容
8.(1)写出①HAc、②NaOH、③H2CO3、④CH3COONH4在水中的电离方程式:①HAc?H++Ac-;②NaOH=Na++OH-;③H2CO3?H++HCO3-;④CH3COONH4=CH3COO-+NH4+.(2)写出①HAc和②NaOH、②NaOH和CH3COONH4反应的离子方程式:①HAc+OH-=Ac-+H2O;②NH4++OH-=NH3•H2O.
分析 ①HAc为弱酸,部分电离,用可逆号;
②NaOH是强碱,为强电解质,完全电离,用等号;
③H2CO3为多元弱酸,是弱电解质,分步电离,以第一步为主;
④CH3COONH4为强电解质,完全电离用等号;
醋酸与氢氧化钠反应生成醋酸钠和水;
氢氧化钠与醋酸铵反应生成醋酸钠和一水合氨.
解答 解:(1)①HAc为弱酸,部分电离,电离方程式:HAc?H++Ac-;
故答案为:HAc?H++Ac-;
②NaOH是强碱,为强电解质,完全电离,电离方程式:NaOH=Na++OH-;
故答案为:NaOH=Na++OH-;
③H2CO3为多元弱酸,是弱电解质,分步电离,以第一步为主,电离方程式:H2CO3?H++HCO3-;
故答案为:H2CO3?H++HCO3-;
④CH3COONH4为强电解质,完全电离,电离方程式:CH3COONH4=CH3COO-+NH4+;
故答案为:CH3COONH4=CH3COO-+NH4+;
(2)醋酸与氢氧化钠反应生成醋酸钠和水,离子方程式:HAc+OH-=Ac-+H2O;
氢氧化钠与醋酸铵反应生成醋酸钠和一水合氨,离子方程式:NH4++OH-=NH3•H2O;
故答案为:HAc+OH-=Ac-+H2O;NH4++OH-=NH3•H2O.
点评 本题考查了电解质电离方程式的书写、离子方程式的书写,明确电解质强弱及电离方式是解题关键,题目难度不大,注意多元弱酸分步电离.

练习册系列答案
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案
相关题目
18.高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色.实验流程如下:
请回答:
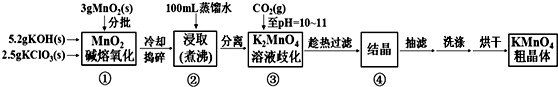
(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
MnO2熔融氧化:3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
请回答:

(1)步骤①应在D中熔化,并用铁棒用力搅拌,以防结块.
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是B.
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低.
(3)烘干时,温度控制在80℃为宜,理由是如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解.
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极.请写出阳极的电极反应式MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率.
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数).
①量取KMnO4溶液应选用酸式(填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小(填“偏大”、“偏小”或“不变”).
②滴定过程中反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.(已知:常温下0.01mol/L的H2C2O4溶液的pH为2.1).
19.正丁烷的二氯取代产物有几种( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
16.pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验:
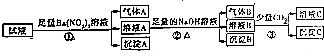
下列有关判断正确的是( )

下列有关判断正确的是( )
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
3. 松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )
 松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )
松油醇是一种天然有机化合物,存在于芳樟油、玉树油及橙花油等天然植物精油中,具有紫丁香香气,在香料工业中用途广泛,主要用于香皂及化妆品香料和调和香精.松油醇结构如下所示,下列有关松油醇的叙述错误的是( )| A. | 松油醇的分子式为C10H18O | |
| B. | 松油醇能发生加成反应、消去反应、氧化反应、酯化反应 | |
| C. | 松油醇存在酚类的同分异构体,分子中有2个手性碳原子 | |
| D. | 松油醇分子在核磁共振氢谱中有9个吸收峰 |
2. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.
(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
①试比较K1,K2的大小,K1>K2(填写“>”、“=”或“<”).
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)A2D2分子的电子式为
 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.(2)B、C、D三种元素的第一电离能由小到大的顺序为C<O<N.
(3)单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(4)下列叙述正确的是ad(填序号).
a. M是极性分子,N是非极性分子
b. M和BD2分子中的中心原子均采用sp2杂化
c. N分子中含有6个σ键和1个π键
d. BD2晶体的熔点、沸点都比二氧化硅晶体的低
(5)已知:①E的一种氧化物Q,其晶胞结构如图所示
①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=-221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g)△H=-81kJ/mol
(6)在0.5L的密闭容器中,一定量的C2和A2进行如下化学反应:C2(g)+3A2(g)=2CA3(g)△H<0,其化学平衡常数K与温度t的关系如表.请回答下列问题.
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
②在400℃时,当测得CA3和C2、A2的物质的量分别为3mol和1mol、2mol时,则该反应的 V(C2)正>(C2)逆(填写“>”、“=”或“<”).
9.1999年1月,俄美科学家联合小组宣布合成出114号元素中的一种同位素,该同位素原子的质量数为298.以下叙述不正确的是( )
| A. | 该元素属于第6周期 | |
| B. | 该元素位于IVA族 | |
| C. | 该元素为金属元素,性质与82Pb(铅)相似 | |
| D. | 该元素原子含有114个电子和184个中子 |
 →
→
 .
.