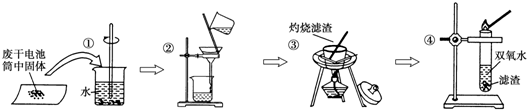
题目内容
15.把100mL含有NH4Cl和(NH4)2 SO4的混合溶液分成2等份,一份加入含a mol NaOH的溶液,加热,恰好使NH4+完全以气体排出;另一份加入含bmol BaCl2的溶液,恰好使SO42-完全沉淀;则该混合溶液中Cl-物质的量浓度为( )| A. | 10 (b-2a) mol•L-1 | B. | 10(2a-b) mol•L-1 | C. | 20(a-2b) mol•L-1 | D. | 20(b-2a) mol•L-1 |
分析 a mol NaOH刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有amolNH4+,与氯化钡溶液完全反应消耗bmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-bmol;根据溶液不显电性,计算出每份中Cl-的物质的量,再根据c=$\frac{n}{V}$计算该混合溶液中Cl-物质的量浓度.
解答 解:a mol NaOH刚好把NH3全部赶出,根据NH4++OH-═NH3+H2O可知每份中含有amolNH4+,与氯化钡溶液完全反应消耗bmolBaCl2,根据Ba2++SO42-═BaSO4↓可知每份含有SO42-bmol,
设每份中Cl-的物质的量为x,根据溶液不显电性,则:amol×1=bmol×2+x×1,
解得:x=(a-2b)mol
每份溶液的体积为0.05L,所以每份溶液氯离子的浓度为:c(Cl-)=$\frac{(a-2b)mol}{0.05L}$=20(a-2b)mol•L-1,
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,明确每份溶液中离子的物质的量浓度与原溶液的关系及溶液中的电荷守恒为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
16.pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验:
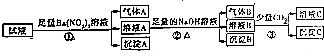
下列有关判断正确的是( )

下列有关判断正确的是( )
| A. | 试液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 试液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
3.下列说法中错误的是( )
| A. | 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性 | |
| B. | 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀 | |
| C. | 二氧化硫能漂白某些物质,说明它具有氧化性 | |
| D. | 二氧化硫漂白过的草帽过一段时间后变黄 |
10.某中学生利用水果设计了一套原电池装置.原电池的能量转化方式是( )
| A. | 化学能转化成光能 | B. | 化学能转化成电能 | ||
| C. | 光能转化成化学能 | D. | 电能转化成光能 |
20.下列化学用语正确的是( )
| A. | 原子核内有8个中子的氧原子:18O | B. | Na2O的电子式: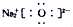 | ||
| C. | HClO 的结构式:H一CI一O | D. | F一的结构示意图: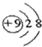 |
5.用一种试剂鉴别苯酚、己烯、碘化钾溶液、苯四种液体,可选用( )
| A. | 盐酸 | B. | FeCl3溶液 | C. | 溴水 | D. | 四氯化碳 |
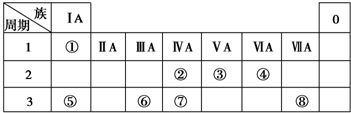
 →
→
 .
.