题目内容
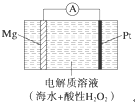 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )| A、电池的负极反应为Mg-2e-═Mg2+ |
| B、电池工作时,H+向负极移动 |
| C、电池工作一段时间后,溶液的pH增大 |
| D、电池总反应式是Mg+H2O2+2H+═Mg2++2H2O |
考点:原电池和电解池的工作原理
专题:
分析:由图可知该燃料电池中,镁作负极,负极反应为Mg-2e-═Mg2+;铂作正极,正极上双氧水得电子生成水,正极反应为H2O2+2H++2e-═2H2O,以此来解答.
解答:
解:A.Mg为负极,则电池的负极反应为Mg-2e-═Mg2+,故A正确;
B.电池工作时,H+向正极移动,故B错误;
C.电池总反应式是Mg+H2O2+2H+═Mg2++2H2O,消耗氢离子,则电池工作一段时间后,溶液的pH增大,故C正确;
D.负极反应为Mg-2e-═Mg2+,正极反应为H2O2+2H++2e-═2H2O,则电池总反应式是Mg+H2O2+2H+═Mg2++2H2O,故D正确;
故选B.
B.电池工作时,H+向正极移动,故B错误;
C.电池总反应式是Mg+H2O2+2H+═Mg2++2H2O,消耗氢离子,则电池工作一段时间后,溶液的pH增大,故C正确;
D.负极反应为Mg-2e-═Mg2+,正极反应为H2O2+2H++2e-═2H2O,则电池总反应式是Mg+H2O2+2H+═Mg2++2H2O,故D正确;
故选B.
点评:本题考查原电池原理,为高频考点,把握正负极的判断及发生的电极反应为解答本题关键,注意原电池的工作原理,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
实验室里进行过滤和蒸发操作时,都要用到的仪器是( )
| A、烧杯 | B、玻璃棒 |
| C、蒸发皿 | D、温度计 |
在相同温度,等物质的量浓度的NaHCO3与Na2CO3溶液中,下列判断不正确的( )
| A、均存在电离平衡和水解平衡 |
| B、存在的粒子种类相同 |
| C、c(OH-)前者大于后者 |
| D、分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)═Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是( )
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A、上述生成Ni(CO)4的反应为吸热反应 |
| B、25℃时,反应Ni(CO)4(g)═Ni(s)+4CO(g)的平衡常数为2×10-5 |
| C、80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol?L-1 |
| D、80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol?L-1,则此时υ(正)>υ(逆) |
下列关于电解池的叙述中,不正确的是( )
| A、在电解池的阳极发生氧化反应 |
| B、与电源负极相接的是电解池的阴极 |
| C、电子从电源的负极沿导线流向电解池的阴极 |
| D、与电源正极相接的是电解池的阴极 |
在无色透明的强酸性溶液中可以大量共存的离子组是( )
| A、Na+、NO3-、Mg2+、Cl- |
| B、Na+、CO32-、NO3-、Ca2+ |
| C、K+、Cl-、SO42-、Cu2+ |
| D、Ba2+、Cl-、K+、SO42- |