题目内容
在无色透明的强酸性溶液中可以大量共存的离子组是( )
| A、Na+、NO3-、Mg2+、Cl- |
| B、Na+、CO32-、NO3-、Ca2+ |
| C、K+、Cl-、SO42-、Cu2+ |
| D、Ba2+、Cl-、K+、SO42- |
考点:离子共存问题
专题:
分析:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,强酸性溶液中存在大量氢离子,
A.Na+、NO3-、Mg2+、Cl-之间不满足离子反应发生条件,都不与氢离子反应,且为无色溶液;
B.碳酸根离子与钙离子反应生成碳酸钙沉淀,碳酸根离子与氢离子反应;
C.铜离子为有色离子,不满足溶液无色的要求;
D.钡离子与硫酸根离子反应生成难溶物硫酸钡.
A.Na+、NO3-、Mg2+、Cl-之间不满足离子反应发生条件,都不与氢离子反应,且为无色溶液;
B.碳酸根离子与钙离子反应生成碳酸钙沉淀,碳酸根离子与氢离子反应;
C.铜离子为有色离子,不满足溶液无色的要求;
D.钡离子与硫酸根离子反应生成难溶物硫酸钡.
解答:
解:A.Na+、NO3-、Mg2+、Cl-之间不发生反应,都不与氢离子反应,且为无色溶液,在溶液中能够大量共存,故A正确;
B.CO32-、Ca2+之间反应生成难溶物碳酸钙,CO32-与强酸性溶液反应,在溶液中不能大量共存,故B错误;
C.Cu2+为有色离子,不满足溶液无色的条件,故C错误;
D.Ba2+、SO42-之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故D错误;
故选A.
B.CO32-、Ca2+之间反应生成难溶物碳酸钙,CO32-与强酸性溶液反应,在溶液中不能大量共存,故B错误;
C.Cu2+为有色离子,不满足溶液无色的条件,故C错误;
D.Ba2+、SO42-之间反应生成硫酸钡沉淀,在溶液中不能大量共存,故D错误;
故选A.
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
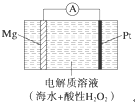 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )| A、电池的负极反应为Mg-2e-═Mg2+ |
| B、电池工作时,H+向负极移动 |
| C、电池工作一段时间后,溶液的pH增大 |
| D、电池总反应式是Mg+H2O2+2H+═Mg2++2H2O |
下列说法正确的是( )
| A、分子中键能越大,键长越长,则分子越稳定 |
| B、水分子可表示为H-O-H,分子中键角为180. |
| C、H-O键键能为463KJ/mol,即18gH2O分解成H2和O2时消耗能量为2×463KJ |
| D、元素周期表中的第ⅠA族和第ⅦA族元素的原子间可以形成共价键 |
下列各组离子可以在溶液中大量共存的是( )
| A、K+、Mg2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |
需要加入适当氧化剂才能实现的变化是( )
| A、P→PCl5 |
| B、HNO3→NO2 |
| C、Cl2→Cl- |
| D、KClO3→KCl |
有一澄清透明的溶液,只可能含有Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀.下列判断正确的是( )
| A、一定不含Fe3+和Fe2+ |
| B、溶液可能含有AlO2- |
| C、溶液可能含有NO3- |
| D、可能含有Fe3+但一定不含Fe2+ |