题目内容
已知2A2(g)+B2(g)?2BA2(g)△H=-akJ?mol-1(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达到平衡后BA2的浓度为wmol?L-1,放出热量bkJ.
(1)a (填“>”、“=”或“<”)b.
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”、“减小”或“不变”).
(3)若在原来的容器中,只加入2mol BA2,500℃时充分反应达平衡后,吸收热量ckJ,BA2浓度 (填“>”、“=”或“<”) wmol?L-1,a,b,c之间满足关系: (用代数式表示).
(4)能说明该反应已经达到平衡状态的是 (填字母,下同).
a.v正(BA2)=2v正(B2)
b.容器内压强保持不变
c.v逆(A2)=2v正(B2)
d.容器内的密度保持不变
(5)既使该反应的反应速率增大,又能使平衡向正反应方向移动的措施是 .
a.及时分离出BA2气体
b.适当长高温度
c.增大B2的浓度
d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500
℃时充分反应达平衡后,放出热量dkJ,则d (填“>”、“=”或“<”)b.
(1)a
(2)若将反应温度升高到700℃,该反应的平衡常数将
(3)若在原来的容器中,只加入2mol BA2,500℃时充分反应达平衡后,吸收热量ckJ,BA2浓度
(4)能说明该反应已经达到平衡状态的是
a.v正(BA2)=2v正(B2)
b.容器内压强保持不变
c.v逆(A2)=2v正(B2)
d.容器内的密度保持不变
(5)既使该反应的反应速率增大,又能使平衡向正反应方向移动的措施是
a.及时分离出BA2气体
b.适当长高温度
c.增大B2的浓度
d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A2和1mol B2,500
℃时充分反应达平衡后,放出热量dkJ,则d
考点:化学平衡的计算,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,据此判断a、b大小关系;
(2)根据反应的热效应判断化学平衡常数的变化;
(3)两个反应为等效平衡,达到平衡时各组分的物质的量浓度相等;
相同条件下,2mol C达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,据此判断;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(5)根据化学反应速率影响因素和化学平衡移动影响因素判断;
(6)恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多.
(2)根据反应的热效应判断化学平衡常数的变化;
(3)两个反应为等效平衡,达到平衡时各组分的物质的量浓度相等;
相同条件下,2mol C达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,据此判断;
(4)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(5)根据化学反应速率影响因素和化学平衡移动影响因素判断;
(6)恒压条件下,由于始终保持较大压强,转化的越多,放出热量较多.
解答:
解:(1)热化学方程式表达的意义为:当2mol A2和1mol B2完全反应时,放出热量为akJ,而加入2mol A2和1mol B2达到平衡时,没有完全进行,即释放的热量小于完全反应释放的热量,即b<a,
故答案为:>;
(2)正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小,故答案为:减小;
(3)相同条件下,2mol C达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,所以BA2浓度=wmol?L-1;
即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,则:b+c=a,
故答案为:=;a=b+c;
(4)a.v正(BA2)=2v正(B2),从反应开始平衡一直满足该等量关系,所以不能作平衡状态的标志,故a错误;
b.该反应前后气体体积不相等,若容器内压强保持不变,说明总物质的量不变,正逆反应速率相等,达到平衡状态,故b正确;
c.v逆(A2)=2v正(B2),表示正逆反应速率相等,说明达平衡状态,故c正确;
d.该反应前后都是气体,则气体的质量不变,容器的容积不变,则气体的密度始终不变,所以密度大小不能作平衡状态的标志,故d错误;
故答案为:bc;
(5)a、生成物浓度降低,则化学反应速率减小,故a错误;
b、升高温度,化学反应速率增大,但化学平衡向逆反应方向移动,故b错误;
c、反应物浓度增大,化学反应速率增大,化学平衡向正反应方向移动,故c正确;
d、催化剂只影响反应速率,不影响化学平衡,故d错误;
故答案为:c;
(6)恒压条件下,相当给原平衡加压,由于始终保持较大压强,平衡正向移动,转化率变大,放热热量多,所以d>b,故答案为:>.
故答案为:>;
(2)正反应方向放热,升高温度,化学平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,K减小,故答案为:减小;
(3)相同条件下,2mol C达到平衡状态时,与加入2mol A2和1mol B2达建立完全相同的平衡状态,所以BA2浓度=wmol?L-1;
即从化学平衡状态到完全反应生成2molC,放出热量为c kJ,则:b+c=a,
故答案为:=;a=b+c;
(4)a.v正(BA2)=2v正(B2),从反应开始平衡一直满足该等量关系,所以不能作平衡状态的标志,故a错误;
b.该反应前后气体体积不相等,若容器内压强保持不变,说明总物质的量不变,正逆反应速率相等,达到平衡状态,故b正确;
c.v逆(A2)=2v正(B2),表示正逆反应速率相等,说明达平衡状态,故c正确;
d.该反应前后都是气体,则气体的质量不变,容器的容积不变,则气体的密度始终不变,所以密度大小不能作平衡状态的标志,故d错误;
故答案为:bc;
(5)a、生成物浓度降低,则化学反应速率减小,故a错误;
b、升高温度,化学反应速率增大,但化学平衡向逆反应方向移动,故b错误;
c、反应物浓度增大,化学反应速率增大,化学平衡向正反应方向移动,故c正确;
d、催化剂只影响反应速率,不影响化学平衡,故d错误;
故答案为:c;
(6)恒压条件下,相当给原平衡加压,由于始终保持较大压强,平衡正向移动,转化率变大,放热热量多,所以d>b,故答案为:>.
点评:本题考查了化学平衡的计算、化学反应速率、化学平衡的影响因素、化学平衡状态的判断等知识,题目都能增大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
下列物质的水溶液,因为水解而使溶液呈酸性的是( )
| A、NaHSO4 |
| B、NaHCO3 |
| C、AlCl3 |
| D、Na2SO4 |
铋(Bi)在医药方面有重要应用.下列关于
Bi和
Bi的说法正确的是( )
209 83 |
210 83 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
下列离子方程式不正确的是( )
| A、将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D、氯气通入水中:Cl2+H2O?H++HClO+Cl- |
下列表达式正确的是( )
| A、NaHCO3的电离:NaHCO3?HCO3-+Na+ |
| B、CH3COONH4的电离:CH3COONH4=NH4++CH3COO- |
| C、Na2S的水解:S2-+2H2O?H2S+2OH- |
| D、FeCl3的水解:Fe3++3H2O?Fe(OH)3↓+3H+ |
实验室中要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和应称取的NaCl分别是( )
| A、480 mL、117g |
| B、500mL、58.5g |
| C、480 mL、58.5 g |
| D、500mL、117g |
常温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验①反应后的溶液中:c(OH-)=c(H+)+c(HA) |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.2 mol/L |
| D、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
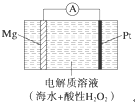 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )| A、电池的负极反应为Mg-2e-═Mg2+ |
| B、电池工作时,H+向负极移动 |
| C、电池工作一段时间后,溶液的pH增大 |
| D、电池总反应式是Mg+H2O2+2H+═Mg2++2H2O |
