题目内容
在相同温度,等物质的量浓度的NaHCO3与Na2CO3溶液中,下列判断不正确的( )
| A、均存在电离平衡和水解平衡 |
| B、存在的粒子种类相同 |
| C、c(OH-)前者大于后者 |
| D、分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
考点:盐类水解的原理
专题:
分析:A.溶液中存在水的电离平衡,盐的水解平衡;
B.根据电离方程和水解方程判断;
C.NaHCO3的水解程度小于Na2CO3;
D.分别加入NaOH固体会抑制Na2CO3的水解,与NaHCO3反应生成Na2CO3.
B.根据电离方程和水解方程判断;
C.NaHCO3的水解程度小于Na2CO3;
D.分别加入NaOH固体会抑制Na2CO3的水解,与NaHCO3反应生成Na2CO3.
解答:
解:A.NaHCO3与Na2CO3溶液中都存在水的电离平衡,盐的水解平衡,故A正确;
B.NaHCO3溶液中:H2O?H++OH-,HCO3-?CO32-+H+,H2O+HCO3-?H2CO3+OH-;Na2CO3溶液中:H2O?H++OH-,H2O+CO32-?HCO3-+OH-,H2O+HCO3-?H2CO3+OH-,所以存在的粒子种类相同,故B正确;
C.NaHCO3中只存在一步水解,Na2CO3溶液中存在两步水解,NaHCO3的水解程度小于Na2CO3,所以c(OH-)前者小于后者,故C错误;
D.分别加入NaOH固体会抑制Na2CO3的水解,与NaHCO3反应生成Na2CO3,则两种溶液中c(CO32-)均增大,故D正确.
故选C.
B.NaHCO3溶液中:H2O?H++OH-,HCO3-?CO32-+H+,H2O+HCO3-?H2CO3+OH-;Na2CO3溶液中:H2O?H++OH-,H2O+CO32-?HCO3-+OH-,H2O+HCO3-?H2CO3+OH-,所以存在的粒子种类相同,故B正确;
C.NaHCO3中只存在一步水解,Na2CO3溶液中存在两步水解,NaHCO3的水解程度小于Na2CO3,所以c(OH-)前者小于后者,故C错误;
D.分别加入NaOH固体会抑制Na2CO3的水解,与NaHCO3反应生成Na2CO3,则两种溶液中c(CO32-)均增大,故D正确.
故选C.
点评:本题考查了水的电离、盐的水解,题目难度不大,注意把握水解方程式的书写方法、以及影响盐的水解的因素.

练习册系列答案
相关题目
下列离子方程式不正确的是( )
| A、将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B、将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C、向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D、氯气通入水中:Cl2+H2O?H++HClO+Cl- |
对于蒸馏实验中的下列说法错误的是( )
| A、为了更好地控制蒸汽温度,应将温度计向下插入接近液面处 |
| B、为了防止暴沸,在对液体混合物进行蒸馏操作时应该加入沸石 |
| C、为了保证冷凝效果,冷凝水应从冷凝管的下口流入上口流出 |
| D、牛角管的作用是使冷凝后的液体沿着其方向流入锥形瓶 |
下列物质中,不属于合成材料的是( )
| A、塑料 | B、棉花 |
| C、合成纤维 | D、合成橡胶 |
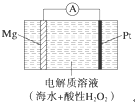 美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )
美国海军海底战事中心与麻省理工大学共同研制成功了用于潜航器的镁过氧化氢燃料电池系统.其工作原理如图所示.以下说法中错误的是( )| A、电池的负极反应为Mg-2e-═Mg2+ |
| B、电池工作时,H+向负极移动 |
| C、电池工作一段时间后,溶液的pH增大 |
| D、电池总反应式是Mg+H2O2+2H+═Mg2++2H2O |
下列相关实验示意图不能达到实验目的是( )
A、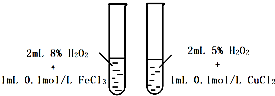 探究不同催化剂对H2O2分解速率影响 |
B、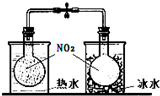 探究温度对2NO2?N2O4平衡影响 |
C、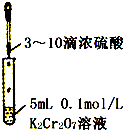 验证Cr2O72-+H2O?2CrO42-+2H+平衡状态变化 |
D、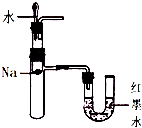 验证钠和水反应的热效应 |
下列各组离子可以在溶液中大量共存的是( )
| A、K+、Mg2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |