题目内容
8.含有一个双键的烯烃,和氢气加成后的产物结构简式如图,则此烃可能有的结构有( )
| A. | 4 种 | B. | 5 种 | C. | 7 种 | D. | 9 种 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.根据加成原理采取逆推法还原C=C双键,烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置.还原双键时注意:先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的一个氢原子形成双键.
解答 解:根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均含有原子的碳原子间是对应烯烃存在C=C的位置,该烷烃 中能形成双键键位置有:1和2之间、2和3之间、3和4之间、3和5之间、5和6之间、6和7之间(6和9)、7和8之间(9和10),故该烯烃共有7种,故选C.
中能形成双键键位置有:1和2之间、2和3之间、3和4之间、3和5之间、5和6之间、6和7之间(6和9)、7和8之间(9和10),故该烯烃共有7种,故选C.
点评 本题考查了加成反应的运用以及同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C=C双键,注意分析分子结构防止重写、漏写,难度不大.

练习册系列答案
相关题目
16.下列化学用语正确的是( )
| A. | (NH4)2Fe(SO4)2溶解于水:(NH4)2Fe(SO4)2?2NH4++Fe2++2SO42- | |
| B. | Al(OH)3在水中的电离:Al(OH)3?Al3++3OH- | |
| C. | H3PO4溶解于水:H3PO4+3H2O?3H3O++PO43- | |
| D. | NaHSO3在水中的电离:HSO3-+H3O+?SO32-+H2O |
19.室温时,下列混合溶液的pH一定小于7的是( )
| A. | pH=3的盐酸和pH=11的氨水等体积混合 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |
16.下列各组的电极材料和电解液,不能组成原电池的是( )
| A. | 铜片、铜片、稀硫酸 | B. | 铜片、石墨棒、硝酸银溶液 | ||
| C. | 锌片、铜片、稀硫酸 | D. | 铜片、银片、FeCl3溶液 |
3.A元素原子最外层电子数是次外层电子数的3倍,B元素原子最外层电子数是次外层电子数的一半,则A、B元素( )
| A. | 一定是第二周期元素 | B. | 一定是同一主族元素 | ||
| C. | 可能是第二、三周期元素 | D. | A、B只能形成化合物B2A |
13.下列有关物质用途的说法中,不正确的是( )
| A. | Fe2O3常用作红色油漆和涂料 | B. | 碳酸氢钠可用于治疗胃酸过多 | ||
| C. | 二氧化硅可用于制造集成电路 | D. | Cl2可用于制漂白粉 |
20.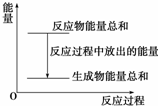 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )| A. | Zn和H2SO4的总能量大于ZnSO4和H2的总能量 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,则Zn为负极 | |
| D. | 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2 L气体 |
18.核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1),则下列有关X的说法中不正确的是( )
| A. | 最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物易溶于水 | D. | 是活泼的非金属元素 |