题目内容
9.化学在生活中无处不在,下列说法错误的是( )| A. | 炒菜时加入一些料酒和食醋,这样可使菜变得味香可口,这是因为有酯类物质生成 | |
| B. | 禁止使用工业酒精配制料酒,这是因为工业酒精中常含有少量会使人中毒的甲醇 | |
| C. | 苯酚不小心蘸到皮肤上,应用NaHCO3溶液擦洗 | |
| D. | 夏季蚊虫较多,一旦被叮咬,就会感到皮肤瘙痒,这是由于蚊虫的分泌液中含有甲酸 |
分析 A.乙酸和乙醇在加热条件下发生酯化反应生成乙酸乙酯和水,乙酸乙酯具有香味;
B.工业酒精含有甲醇,甲醇有毒;
C.苯酚与碳酸氢钠不反应;
D.蚊虫的分泌液中含有甲酸.
解答 解:A.乙酸和乙醇在加热条件下发生酯化反应生成乙酸乙酯和水,乙酸乙酯具有香味,所以炒菜时加入一些料酒和食醋,这样可使菜变得味香可口,故A正确;
B.工业酒精含有甲醇,甲醇有毒,少量使人失明,量多致人死亡,故B正确;
C.酒精没有腐蚀性,苯酚易溶于酒精,可用酒精洗去皮肤上的苯酚,故C错误;
D.蚊虫叮咬皮肤时会分泌蚁酸引起皮肤肿痛,可在叮咬处涂抹肥皂水,中和蚁酸,故D正确;
故选:C.
点评 本题考查了元素化合物知识,熟悉乙醇、甲醇、甲酸、苯酚的性质即可解答,题目难度不大,注意对常见有机物性质的总结.

练习册系列答案
相关题目
19.室温时,下列混合溶液的pH一定小于7的是( )
| A. | pH=3的盐酸和pH=11的氨水等体积混合 | |
| B. | 0.1mol/L的盐酸和0.1mol/L的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |
20.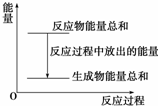 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
 对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )
对于敞口容器中的化学反应:Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g),下列叙述中不正确的是( )| A. | Zn和H2SO4的总能量大于ZnSO4和H2的总能量 | |
| B. | 反应过程中能量关系可用如图表示 | |
| C. | 若将该反应设计成原电池,则Zn为负极 | |
| D. | 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2 L气体 |
4.下列化学实验事实及其结论都正确的是( )
| A. | 将SO2通入含HClO的溶液中生成H2SO4 HClO的酸性比H2SO4强 | |
| B. | 铝箔在酒精灯火焰上加热熔化但不滴落 铝箔表面氧化铝熔点高于铝 | |
| C. | SiO2可以和碱溶液及酸溶液反应 SiO2属于两性氧化物 | |
| D. | 将SO2通入溴水中,溴水褪色 SO2具有漂白性 |
14.已知在1×105Pa、298K的条件下,2mol H2燃烧生成水蒸气时放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=242 kJ•mol-1 | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=242 kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484kJ•mol-1 |
18.核电荷数小于18的某元素X,其原子核外的电子层数为n,最外层电子数为(2n+1),原子核内质子数是(2n2-1),则下列有关X的说法中不正确的是( )
| A. | 最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物易溶于水 | D. | 是活泼的非金属元素 |
19.含氮化合物是化学与工业中运用广泛的物质.
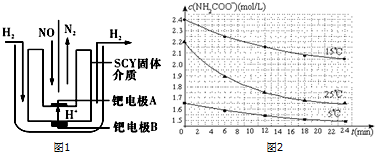
(1)该小组利用电解原理设计了如图1装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极).铂电极B是阳极,钯电极A的电极反应式为2NO+4H++4e-=N2+2H2O.
(2)若工业废水中的NO2-的浓度约为1.0×10-4 mol•L-1,取工业废水5mL 于试管中,滴加2滴0.1mol•L-1的硝酸银溶液,能否看到沉淀现象?试通过计算说明.(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol.请计算热化学方程式2H2(g)+S2(g)=2H2S(g)的△H=-229KJ/mol
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
?根据表中数据,列式计算25.0℃时的分解平衡常数:K=c(CO2)•c2(NH3)=[4.8×10-3×$\frac{2}{3}$]2×[4.8×10-3×$\frac{1}{3}$]=1.64×10-8.
?已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.根据图中信息,如何说明水解反应速率随温度升
高而增大:25.00C时反应物的起始浓度较小,但0-6min的平均反应速率(曲线的斜率)仍比15.00C的大.

(1)该小组利用电解原理设计了如图1装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极).铂电极B是阳极,钯电极A的电极反应式为2NO+4H++4e-=N2+2H2O.
(2)若工业废水中的NO2-的浓度约为1.0×10-4 mol•L-1,取工业废水5mL 于试管中,滴加2滴0.1mol•L-1的硝酸银溶液,能否看到沉淀现象?试通过计算说明.(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol.请计算热化学方程式2H2(g)+S2(g)=2H2S(g)的△H=-229KJ/mol
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g).
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
?已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图2所示.根据图中信息,如何说明水解反应速率随温度升
高而增大:25.00C时反应物的起始浓度较小,但0-6min的平均反应速率(曲线的斜率)仍比15.00C的大.