题目内容
20.下列叙述不正确的是( )| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O═4OH- | |
| C. | 将地下钢管与直流电源的正极相连,用来保护钢管 | |
| D. | 氢氧燃料电池中,氢气在负极发生氧化反应 |
分析 A.金属原子失去电子被氧化;
B.钢铁吸氧腐蚀的正极是氧气发生得电子的还原反应;
C.钢管与直流电源的正极相连,阳极金属易被腐蚀;
D.燃料电池中,燃料在负极发生氧化反应.
解答 解:A.金属腐蚀的本质是金属原子在负极上失去电子而被氧化的过程,故A正确;
B.钢铁吸氧腐蚀的正极是氧气发生得电子的还原反应,电极反应是:O2+4e-+2H2O=4OH-,故B正确;
C.将地下钢管与电源负极相连,作电解池的阴极被保护,能防止钢铁锈蚀,故C错误;
D.氢氧燃料电池中,在负极上是燃料氢气失电子发生氧化反应的过程,故D正确.
故选C.
点评 本题考查学生金属的腐蚀和防护知识以及燃料电池的工作原理知识,属于基础知识的考查,难度中等.

练习册系列答案
相关题目
5.下列说法不正确的是( )
①氢气能在氯气中燃烧产生黄色火焰,生成白烟
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯的水溶液,它能使干燥的有色布条褪色
④氯气能与氢氡化钙反应生成漂白粉,漂白粉的成分只有次氯酸钙
⑤自然界中存在大量氯的单质.
①氢气能在氯气中燃烧产生黄色火焰,生成白烟
②铜丝在氯气中燃烧,生成蓝绿色的氯化铜
③液氯就是氯的水溶液,它能使干燥的有色布条褪色
④氯气能与氢氡化钙反应生成漂白粉,漂白粉的成分只有次氯酸钙
⑤自然界中存在大量氯的单质.
| A. | 只有①⑤ | B. | ①②③ | C. | 全部 | D. | ①④⑤ |
8.关于 1L 0.1mol/L 的(NH4)2Fe(SO4)2溶液,下列说法正确的是( )
| A. | 和过量的 NaOH 溶液充分反应并加热,可生成标准状况下的 NH3 4.48L | |
| B. | 通入 H2S 气体,发生反应的离子方程式为:H2S+Fe2+=FeS↓+2H+ | |
| C. | Ca2+、ClO-、Cl-、Cu2+能在该溶液中大量共存 | |
| D. | Cl-、H+、I-、Na+不能在该溶液中大量共存 |
10.下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A. | 1mol OH-与1mol-OH所含质子数均为9NA | |
| B. | pH=1的H2SO4溶液含H+的数目为0.2NA | |
| C. | 273K,101kPa条件下,14g乙烯与丙烯的混合物中含有的碳原子数目为3NA | |
| D. | 标准状况下,11.2L CCl4含有C-Cl键的数目为2NA |
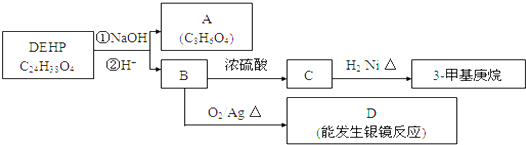
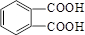 +n HOCH2CH2OH
+n HOCH2CH2OH
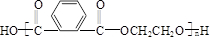 +(2n-1)H2O.
+(2n-1)H2O.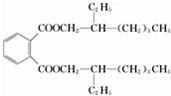 .
.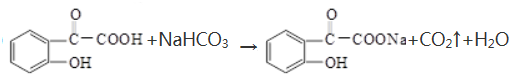 .
.