题目内容
9.在淀粉KI溶液中加入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,所发生的离子方程式是2I-+ClO-+2H+═I2+Cl-+H2O,在上述蓝色溶液中滴加足量的Na2SO3溶液,现象是蓝色逐渐消失,所发生的离子方程式是SO32-+I2+H2O═SO42-+2H++2I-.
分析 在淀粉KI溶液中加入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,说明生成碘,在上述蓝色溶液中滴加足量的Na2SO3溶液,碘与亚硫酸钠发生氧化还原反应,蓝色逐渐消失,以此解答该题,
解答 解:由信息可知,先发生ClO-+2I-+2H+=I2+Cl-+H2O,淀粉变蓝;再发生H2O+I2+SO32-=SO42-+2I-+2H+,蓝色逐渐消失,
故答案为:2I-+ClO-+2H+═I2+Cl-+H2O;蓝色逐渐消失; SO32-+I2+H2O═SO42-+2H++2I-.
点评 本题考查氧化还原反应,为高频考点,把握发生的化学反应,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列说法不正确的是( )
| A. | 氧化性(酸性溶液):PbO2>Fe3+>S | |
| B. | 还原性(碱性溶液):Fe(OH)2>KCl>Cl2 | |
| C. | 酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 | |
| D. | 热稳定性:CaCO3>FeCO3>Ag2CO3 |
20.下列叙述不正确的是( )
| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O═4OH- | |
| C. | 将地下钢管与直流电源的正极相连,用来保护钢管 | |
| D. | 氢氧燃料电池中,氢气在负极发生氧化反应 |
14.结合如图判断,下列叙述正确的是( )
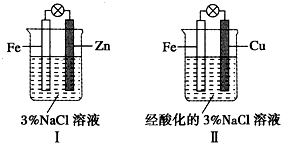

| A. | Ⅰ是验证牺牲阳极的阴极保护法的实验装置 | |
| B. | Ⅰ和Ⅱ中负极反应式均是:Fe-2e-=Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应式均是:2H++2e-=H2 | |
| D. | Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
1.观察下列几个装置示意图,有关叙述正确的是( )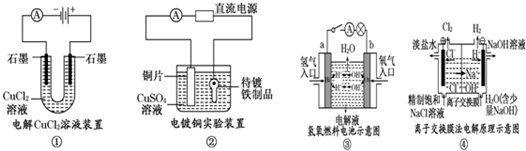

| A. | 装置①中阳极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中外电路电子由a极流向b极 | |
| D. | 装置④的阳极反应为:2H++2e-=H2↑ |

 .
. .
. .
. 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验.请回答下列有关问题: