题目内容
20.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )| A. | CH3CH2CH3 | B. | CH3CH(CH3)CH2CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
分析 核磁共振氢谱图中能给出三种信号,说明分子中含有三种不同的H原子,以此解答该题.
解答 解:A.CH3CH2CH3中有2种H原子,核磁共振氢谱有2个吸收峰,故A错误;
B.CH3CH(CH3)CH2CH3中有4种H原子,核磁共振氢谱有4个吸收峰,故B错误;
C.CH3CH2OH中有3种H原子,核磁共振氢谱有3个吸收峰,故C正确;
D.CH3OCH3中有1种H原子,核磁共振氢谱有1个吸收峰,故D错误.
故选C.
点评 本题以核磁共振氢谱为载体考查有机物的结构,侧重考查学生的分析能力,题目难度较小,清楚核磁共振氢谱中有几个不同的峰,分子中就有几种H原子.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
10.(1)反应 Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.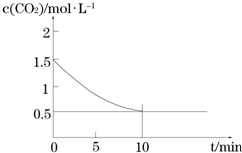
①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.

①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
11.下列反应的离子方程式错误的是( )
| A. | 大理石溶于醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 在氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O═Al (OH)3↓+3NH4+ | |
| C. | 硫氢化钠水解:HS-+H2O?H2S+OH- | |
| D. | Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+═2Fe3++2H2O |
8.下列能正确表示乙烯结构简式的是( )
| A. | C2H4 | B. | CH2 CH2 | C. | CH2--CH2 | D. | CH2=CH2 |
5.目前银川一中部分学生喜欢使用胶带,四氟乙烯(C2F4)是制作胶带胶黏剂的一种原料.
下面是关于四氟乙烯的几种说法:
①它是由碳、氟两种元素组成的化合物,
②它是由氟气(分子式为:F2)和碳组成的化合物
③它的分子中碳、氟两种元素的原子物质的量比为1:2
这些说法中正确的是( )
下面是关于四氟乙烯的几种说法:
①它是由碳、氟两种元素组成的化合物,
②它是由氟气(分子式为:F2)和碳组成的化合物
③它的分子中碳、氟两种元素的原子物质的量比为1:2
这些说法中正确的是( )
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
12.下列变化中必须加入氧化剂才能实现的是( )
| A. | MnO4-→Mn2+ | B. | KClO3→O2 | C. | HCl→Cl2 | D. | Fe3+→Fe2+ |
9.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,2.24L SO3中含有的SO3分子数为0.1NA | |
| B. | 5.6 g Fe与标准状况下2.24L的Cl2充分反应,转移的电子数为0.3NA | |
| C. | 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L | |
| D. | 1molMnO2与4mol浓盐酸充分反应后生成的Cl2分子数为NA |
19.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1(填“>”、“<”或“=”).
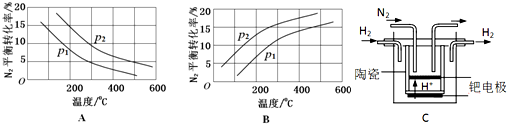
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1(填“>”、“<”或“=”).

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
(已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1)