题目内容
5.化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),下列说法正确的是( )| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
分析 A.发生沉淀的转化,向溶度积更小的方向移动;
B.平衡时,浓度不变;
C.K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$;
D.加入少量CuSO4固体后,c(Cu2+)增大,平衡正向移动.
解答 解:A.发生沉淀的转化,向溶度积更小的方向移动,则MnS的Ksp比CuS的Ksp大,故A错误;
B.平衡时,浓度不变,不一定相等,是否相等与起始浓度、转化率有关,故B错误;
C.K=$\frac{c(M{n}^{2+})}{c(C{u}^{2+})}$=$\frac{c(M{n}^{2+})c({S}^{2-})}{c(C{u}^{2+})c({S}^{2-})}$=$\frac{Ksp(MnS)}{Ksp(CuS)}$,则K×Ksp(CuS)=Ksp(MnS),故C正确;
D.加入少量CuSO4固体后,c(Cu2+)增大,平衡正向移动,则c(Mn2+)变大,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握沉淀的转化,K与Ksp的关系、平衡移动为解答的关键,侧重分析与应用能力的考查,选项B为易错点,题目难度不大.

练习册系列答案
相关题目
13.在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g)?zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
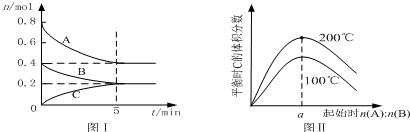

| A. | 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 | |
| C. | 若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) | |
| D. | 200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5 |
20.化学反应速率与限度与生产、生活密切相关
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①哪一时间段(指0~1、1~2、2~3、3~4、4~5min)反应速率最大2~3min,原因是该反应是放热反应,此时温度高,反应速率越大.
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率0.025mol/(L•min).
(设溶液体积不变)
(2)另一学生也做同样的实验,由于反应太快,不好控制测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是CD.
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如右图.
①该反应的化学方程式是3X+Y?2Z.
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是CD.
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为30%.
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
(1)某学生为了探究锌与盐酸反应过程中的速率变化,他在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率0.025mol/(L•min).
(设溶液体积不变)
(2)另一学生也做同样的实验,由于反应太快,不好控制测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是CD.
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,3种气态物质 X、Y、Z的物质的量随时间变化曲线如右图.

①该反应的化学方程式是3X+Y?2Z.
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是CD.
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为30%.
④若上述反应中X、Y、Z分别为H2、N2、NH3,且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.
10.(1)反应 Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
反应CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数为K,
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.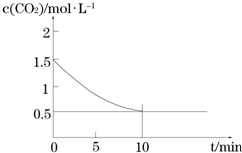
①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
反应 Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;
在不同温度时K1、K2的值如下表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),
且由上述计算可知,反应 CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应
Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示.

①该条件下反应的平衡常数为2;
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉.
17.为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)今有如下两个热化学方程式:?则a>b(填“>”、“=”或“<”)
2H2(g)+O2(g)═2H2O(g)△H1=a kJ•mol-1?
2H2(g)+O2(g)═2H2O(l)△H2=b kJ•mol-1?
(3)
已知反应N2(g)+3H2(g)═2NH3(g)△H=a kJ•mol-1.试根据表中所列键能数据估算a 的值:-93(注明“+”或“-”).
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ•mol-1[
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)今有如下两个热化学方程式:?则a>b(填“>”、“=”或“<”)
2H2(g)+O2(g)═2H2O(g)△H1=a kJ•mol-1?
2H2(g)+O2(g)═2H2O(l)△H2=b kJ•mol-1?
(3)
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ•mol-1[
②2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2(g)的△H=-246.4 kJ•mol-1.
14.同温同体积同质量的下列气体压强最大的是( )
| A. | CO2 | B. | CH4 | C. | N2 | D. | O2 |
 如图都是简化的碳架结构:
如图都是简化的碳架结构: