题目内容
6.某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用.其实验方案如下: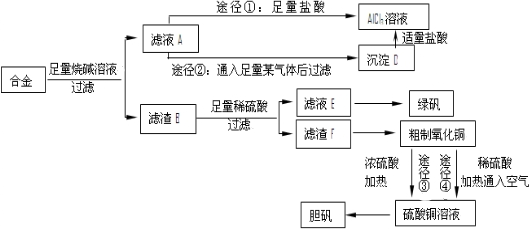
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,有人认为合金与烧碱溶液形成了原电池,则作为原电池负极的物质是Al.
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的是途径②.由AlCl3溶液获得AlCl3晶体的方法是将溶液低温蒸发浓缩过滤,所得固体在氯化氢的氛围里蒸干.
(3)用粗制氧化铜通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是:产生等量胆矾途径④消耗硫酸少、途径④不会产生污染大气的气体.
(4)通过途径④实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、加热浓缩、冷却结晶、过滤、自然干燥.其中“加热通氧气”所起的作用为2Cu+O2+4H+=2Cu2++2H2O(用离子方程式表示).
(5)在测定所得胆矾(CuSO4•xH2O)中结晶水x值的实验过程中:称量操作至少进行4次.若测定结果x值偏高,可能的原因是aef.
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
e.加热时胆矾晶体飞溅出来 f.所用坩埚事先未干燥(潮湿)
分析 含有铝、铁、铜的合金加入足量的氢氧化钠溶解,只有铝与氢氧化钠溶液反应,所以滤渣B为铁和铜,滤液中含有偏铝酸钠与剩余的NaOH,途径①加入足量的盐酸得到氯化铝溶液,途径②通入二氧化碳得到氢氧化铝沉淀,氢氧化铝用盐酸溶解得到氯化铝.滤渣B中用稀硫酸溶解,Cu不反应,过滤分离,滤渣F为Cu、滤液E中含有硫酸亚铁,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到绿矾.粗制氧化铜反应得到硫酸铜,再经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾.
(1)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气;合金与烧碱溶液形成了原电池,Fe、Cu不与氢氧化钠溶液溶液,则Al作负极;
(2)途径①所得的溶液中含有NaCl;应防止氯化铝溶液在加热蒸发过程中水解;
(3)根据消耗硫酸用量及是否生成污染空气的气体分析;
(4)酸性条件下,氧气与粗制氧化铜中的Cu反应得到Cu2+,过滤除去不溶物后,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾;
(5)先称量样品与坩埚质量,再加热分解,称量加热后总质量,两次处理误差在系统误差范围内,说明完全失去结晶水;
a.加热温度过高,硫酸铜可能分解;
b.胆矾晶体的颗粒较大,结晶水不能完全失去;
c.加热后放在空气中冷却,有吸收空气中水蒸气;
d.胆矾晶体部分风化,晶体中结晶水的质量偏小;
e.加热时胆矾晶体飞溅出来,失去的晶体全部按结晶水质量计算;
f.所用坩埚事先未干燥(潮湿),沉淀结晶水的质量偏大.
解答 解:含有铝、铁、铜的合金加入足量的氢氧化钠溶解,只有铝与氢氧化钠溶液反应,所以滤渣B为铁和铜,滤液中含有偏铝酸钠与剩余的NaOH,途径①加入足量的盐酸得到氯化铝溶液,途径②通入二氧化碳得到氢氧化铝沉淀,氢氧化铝用盐酸溶解得到氯化铝.滤渣B中用稀硫酸溶解,Cu不反应,过滤分离,滤渣F为Cu、滤液E中含有硫酸亚铁,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到绿矾.粗制氧化铜反应得到硫酸铜,再经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾.
(1)Al与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,合金与烧碱溶液形成了原电池,Fe、Cu不与氢氧化钠溶液溶液,则Al作负极,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al;
(2)途径①所得的溶液中含有NaCl,途径②是利用氢氧化铝与盐酸反应得到氯化铝,制得氯化铝比较纯,途径②更合理,氯化铝溶液在加热蒸发过程中应防止水解,具体操作为:将溶液低温蒸发浓缩过滤,所得固体在氯化氢的氛围里蒸干,
故答案为:途径②;将溶液低温蒸发浓缩过滤,所得固体在氯化氢的氛围里蒸干;
(3)途径③中Cu会与浓硫酸反应生成硫酸铜与二氧化硫,途径④中Cu与硫酸、氧气反应生成硫酸铜,与途径③相比,途径④明显具有的两个优点是:产生等量胆矾途径④消耗硫酸少、途径④不会产生污染大气的气体,
故答案为:产生等量胆矾途径④消耗硫酸少、途径④不会产生污染大气的气体;
(4)酸性条件下,氧气与粗制氧化铜中的Cu反应得到Cu2+,反应离子方程式为:2Cu+O2+4H+=2Cu2++2H2O,过滤除去不溶物后,经过加热浓缩、冷却结晶、过滤、洗涤等操作得到蓝矾,
故答案为:加热浓缩、过滤;2Cu+O2+4H+=2Cu2++2H2O;
(5)先称量样品与坩埚质量,再加热分解,称量加热后总质量,两次处理误差在系统误差范围内,说明完全失去结晶水,至少进行4次质量称量;
a.加热温度过高,硫酸铜可能分解,测定结晶水质量偏大,导致x值偏高;
b.胆矾晶体的颗粒较大,结晶水不能完全失去,测定结晶水质量偏小,导致x值偏低;
c.加热后放在空气中冷却,有吸收空气中水蒸气,测定结晶水质量偏小,导致x值偏低;
d.胆矾晶体部分风化,晶体中结晶水的质量偏小,导致x值偏低;
e.加热时胆矾晶体飞溅出来,失去的晶体全部按结晶水质量计算,测定结晶水质量偏大,导致x值偏高;
f.所用坩埚事先未干燥(潮湿),沉淀结晶水的质量偏大,导致x值偏高,
故答案为:4;aef.
点评 本题考查物质制备工艺流程,涉及多操作的分析评价、物质的分离提纯、物质含量测定等,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,难度中等.

 阅读快车系列答案
阅读快车系列答案①道尔顿提出的原子论②卢瑟福的原子结构行星模型③玻尔提出的原子力学模型④汤姆孙提出的葡萄干面包原子模型.
| A. | ①②③④ | B. | ①③②④ | C. | ②①④③ | D. | ①④②③ |
| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
| A. | 都比较稳定,久置不变浑浊 | B. | 相同的颜色 | ||
| C. | 有丁达尔现象 | D. | 加盐酸先产生沉淀,后沉淀溶解 |
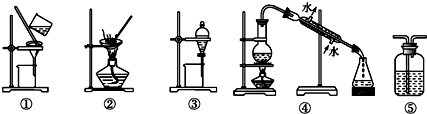
| A. | 用FeCl2溶液吸收Cl2,选⑤ | B. | 分离Na2CO3溶液和油脂,选④ | ||
| C. | 用四氯化碳提取碘水中的碘,选③ | D. | 粗盐提纯,选①和② |