题目内容
16.500mL硝酸钾和硝酸铜的混合溶液中c(NO3-)═6.0mol/L,用石墨做电极电解此溶液,当通电一段时间后两极均收集到22.4L气体(标准状况).下列说法正确的是( )| A. | 原混合溶液中钾离子浓度为2 mol/L | |
| B. | 上述电解过程中共转移6摩尔电子 | |
| C. | 电解得到的铜的物质的量为0.5摩尔 | |
| D. | 电解后溶液中的pH=2 |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),阴极发生反应为:Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生反应为:4OH--4e-═O2↑+2H2O,n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,
阳极发生电极反应为:4OH--4e-═O2↑+2H2O,
4mol 4mol 1mol
阴极发生的电极反应为:Cu2++2e-═Cu、2H++2e-═H2↑
1mol 2mol 1mol 2mol 2mol 1mol
A.c(Cu2+)=$\frac{1mol}{0.5L}$=2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L,故A正确;
B.根据氧气计算转移电子的物质的量,转移电子的物质的量=1mol×4=4mol,故B错误;
C.电解得到的Cu的物质的量为1mol,故C错误;
D.电解后溶液中c(H+)为:$\frac{4mol-2mol}{0.5L}$=4mol/L,氢离子浓度不是0.01mol/L,溶液的pH≠2,故D错误;
故选A.
点评 本题考查混合物计算,题目难度中等,明确发生的电极反应及电子守恒是解答本题的关键,难点是D,注意氢氧根离子与氢离子的关系解答,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
4.鉴别NaCl、NaBr、NaI可以采用的试剂是( )
| A. | 碘水、淀粉溶液 | B. | 碘化钾淀粉溶液 | C. | 氯水、CCl4 | D. | 溴水、汽油 |
1.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
| A. | 等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c( HC2O4-)+c( C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3溶液中加入等体积0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
5.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
| A. | 向0.10mol/L NH4HCO3中溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10mol/L NaHSO3中溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10mol/L Na2SO3中溶液中通入SO2:c(Na+)=2[c(H2SO3)+c(HSO3-)+c(SO32-)] | |
| D. | 向0.10mol/L CH3COONa中溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
6.下列反应的离子方程式正确的是( )
| A. | 用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-═AlO2-+H2↑ | |
| B. | 向碳酸氢钠溶液中加入少量氢氧化钙:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 氧化铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| D. | Na2S溶液显碱性:S2-+H2O?HS-+OH- |
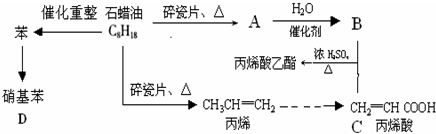
 A→B的反应类型:加成反应
A→B的反应类型:加成反应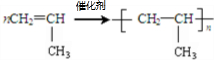 ;
;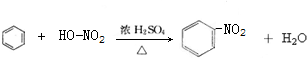 ,
,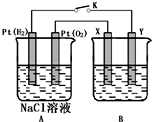 某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题: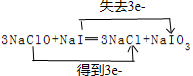 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3.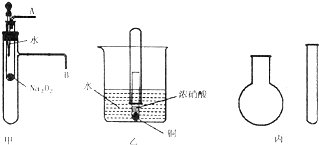 “套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题:
“套管实验”是将一支较小的玻璃仪器装入另一支玻璃仪器中,经组装来完成原来需要较多仪器进行的实验.因其具有许多优点,已被广泛应用于化学实验中.下列三个实验均为“套管实验”,请观察、分析,回答下列问题: