题目内容
18.由反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )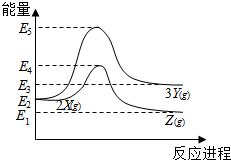
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
分析 由图象可知2X(g)≒3Y(g)为吸热反应,而2X(g)≒2Z(g)为放热反应,反应热等于反应物的总能量-生成物的总能量,结合温度、压强对平衡移动的影响解答该题.
解答 解:A.根据化学反应的实质,由X→Y反应的△H=E3-E2,故A错误;
B.由图象可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即由反应的△H<0,故B正确;
C.根据化学反应2X(g)≒3Y(g),该反应是气体系数和增加的可逆反应,降低压强,平衡正向移动,有利于提高Y的产率,故C正确;
D.由B分析可知,该反应为放热反应,升高温度,平衡逆向移动,Z的产率降低,故D错误.
故选BC.
点评 本题考查了化学反应中能量的变化图,为2016年海南高考题,侧重于学生的分析能力的考查,注意把握图象的分析,注意根据反应物的总能量与生成物的总能量进行比较,题目较简单.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
9.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18gH216O和20gH218O含有的质子数均为10NA | |
| B. | 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2═2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
6.Li-Al/FeS电池是某科研机构正在研发的一种车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe.有关该电池的下列说法正确的是( )
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
13.油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热△H为( )
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热△H为( )
| A. | 3.8×104kJ•mol-1 | B. | -3.8×104kJ•mol-1 | ||
| C. | 3.4×104kJ•mol-1 | D. | -3.4×104kJ•mol-1 |

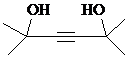 .
.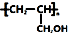 ,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
,写出合成流程图(无机试剂任用).合成流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.