题目内容
13.油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热△H为( )
| A. | 3.8×104kJ•mol-1 | B. | -3.8×104kJ•mol-1 | ||
| C. | 3.4×104kJ•mol-1 | D. | -3.4×104kJ•mol-1 |
分析 C57H104O6的相对分子质量为884,已知燃烧1kg该化合物释放出热量3.8×104kJ,可首先计算1kg该化合物的物质的量,则计算1mol该化合物燃烧放出的热量,进而计算燃烧热.
解答 解:燃烧热指的是燃烧1mol可燃物生成稳定的氧化物所放出的热量.燃烧1kg油酸甘油酯释放出热量3.8×104kJ,
则1kg该化合物的物质的量为$\frac{1000g}{884g/mol}$,则油酸甘油酯的燃烧热△H=-$\frac{3.8×1{0}^{4}kJ}{\frac{1000g}{884g/mol}}$=-3.4×104kJ•mol-1,
故选D.
点评 本题为2016年海南高考题,考查燃烧热的计算,侧重学生的分析、计算能力的考查,解答本题注意相对分子质量的计算,注意相关计算公式的运用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.短周期元素X、Y、Z、W的原子序数依次增大,X、Y、Z同主族,W的氧化物是形成酸雨的主要原因之一.下列说法正确的是( )
| A. | Y的单质在氧气中燃烧生成Y2O | |
| B. | X、W的简单离子均能促进水的电离 | |
| C. | 原子半径由小到大的顺序为X<Y<Z<W | |
| D. | Z单质加入到Y的可溶性盐溶液中,可以置换出Y |
4.下列关于有机物的说法错误的是( )
| A. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| B. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| C. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| D. | 淀粉、油脂、蛋白质都能水解,但水解产物不同 |
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 标准状况下,22.4 L由CO和N2组成的混合气体中含有2NA个原子 | |
| C. | 一定量的浓H2SO4与0.1 mol Mg恰好完全反应,生成的SO2分子数一定为0.1NA | |
| D. | 1.6 g-NH2和1.5 g-CH3含有的电子数均为NA |
8.下列物质中,其主要成分不属于烃的是( )
| A. | 汽油 | B. | 甘油 | C. | 煤油 | D. | 柴油 |
18.由反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )
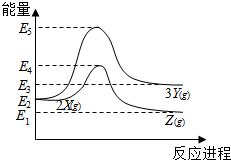

| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
5.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2:1的有( )
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2-甲基丙烷 | D. | 对苯二甲酸 |