题目内容
6.Li-Al/FeS电池是某科研机构正在研发的一种车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe.有关该电池的下列说法正确的是( )| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
分析 Li-Al/FeS电池是一种二次电池,原电池工作时,较为活泼的单质锂作负极,阳离子向正极移动,阴离子向负极移动,正负极反应相加可得反应的电池总反应,充电时,阴极上电极反应式与原电池负极电极反应式正好相反.
解答 解:A.Li-Al在电池中作为负极材料,Li为单质,为0价,故A错误;
B.水和锂要发生反应,所以不能用水作电解质溶液,故B错误;
C.正极反应2Li++FeS+2e-=Li2S+Fe与负极反应2Li-2e-=2Li+相加可得反应的电池反应式为:2Li+FeS=Li2S+Fe,故C正确;
D.充电时,阴极上电极反应式与原电池负极电极反应式正好相反,阴极上电极反应式为Li++e-=Li,故D错误;
故选:C.
点评 本题考查了化学电源新型电池,根据原电池原理来分析解答,知道电极上发生的反即可解答,电极反应式的书写是学习难点,总结归纳书写规律,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列说法正确的是( )
| A. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-丙基戊烷 | |
| B. | 已知C-C键可以绕键轴自由旋转,结构简式为 分子中至少有7个碳原子处于同一直线上 分子中至少有7个碳原子处于同一直线上 | |
| C. | 肌醇 与葡萄糖 与葡萄糖 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 的元素组成相同,化学式均为C6H12O6,满足Cm(H2O)n,因此,均属于糖类化合物 | |
| D. |  与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H6O6Na4 |
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 标准状况下,22.4 L由CO和N2组成的混合气体中含有2NA个原子 | |
| C. | 一定量的浓H2SO4与0.1 mol Mg恰好完全反应,生成的SO2分子数一定为0.1NA | |
| D. | 1.6 g-NH2和1.5 g-CH3含有的电子数均为NA |
11.下列叙述错误的是( )
| A. | 氦气可用于填充飞艇 | B. | 氯化铁可用于硬水的软化 | ||
| C. | 石英砂可用于生产单晶硅 | D. | 聚四氟乙烯可用于厨具表面涂层 |
18.由反应物X转化为Y和Z的能量变化如图所示.下列说法正确的是( )
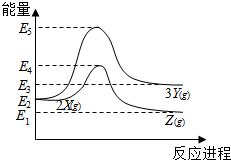

| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
6.W、X、Y、Z均是短周期元素,W是地壳中含量最多的元素,X的氧化物具有两性,Z原子的半径是所在周期中最大的,X、Y、Z处于同一周期,Y的最高正价与最低负价的代数和为0.下列说法正确的是( )
| A. | 原子序数:X>Y>Z>W | |
| B. | 离子半径:W>X>Z | |
| C. | W分别与Y、Z形成的化合物中化学键类型不同 | |
| D. | 气态氢化物的稳定性:W<Y |
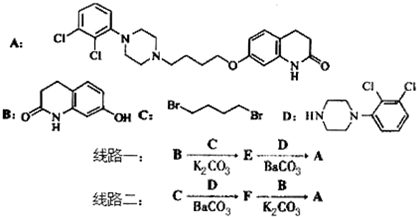
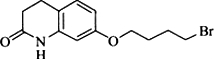 ,其含氧官能团有肽键、醚键(写名称).
,其含氧官能团有肽键、醚键(写名称).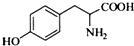 、
、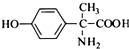 .
.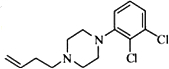 .
.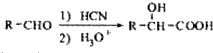 写出由C制备化合物
写出由C制备化合物