题目内容
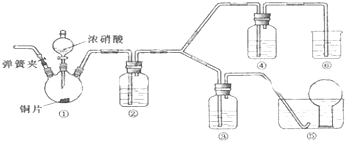
17.由两种常见元素组成的化合物X,广泛用于机械制造、石油化工、汽车尾气处理等领域.测定化合物X组成的实验如下:
(1)X的化学式Fe3C.
(2)溶液C和H2O2反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)CH4、H2和单质B的氧化物在一定条件下反应可制备X,同时生成另一种氧化物,写出该反应的化学方程式2CH4+5H2+3Fe2O3=2Fe3C+9H2O.
(4)有人推测X能与单质B的氧化物反应生成单质B,从氧化还原反应的角度举例说明该反应的合理性Fe3C中碳元素化合价升高做还原剂,铁的氧化物中铁元素化合价降低做氧化剂,如Fe3C+Fe2O3=5Fe+3CO.
(5)向血红色溶液D中加入下列物质,血红色褪去的是AD.
A.Fe B.CuCl2 C.H2SO4 D.KMnO4.
分析 1.80gX隔绝空气加热分解生成AB两种单质,单质A和氧气反应生成无色无味气体,通入澄清石灰水得到白色沉淀10.0g为碳酸钙,单质A为C,单质B和稀硫酸反应生成溶液C,加入过氧化氢和KSCN出现血红色溶液D说明含铁元素,证明单质B为Fe,结合元素守恒碳元素物质的量=$\frac{10.0g}{100g/mol}$=0.1mol,含碳元素质量=0.1mol×12g/mol=1.2g,铁元素物质的量=$\frac{18.0g-1.2g}{56g/mol}$=0.3mol,则铁和碳人长大了之比n(Fe):n(C)=0.3:0.1=3:1,化学式为Fe3C,
(1)上述计算得到化学式;
(2)溶液C为硫酸亚铁和水在高温下反应生成氢气和一氧化碳;
(3)CH4、H2和单质B为Fe的氧化物在一定条件下反应可制备X,同时生成另一种氧化物为水,依据原子守恒配平书写得到化学方程式;
(4)氧化还原反应中元素化合价有升高就有降低,分析反应中元素化合价变化是否符合判断;
(5)向血红色溶液D中存在化学平衡Fe3++3SCN-?Fe(SCN)3,平衡逆向进行红色褪去;
解答 解:1.80gX隔绝空气加热分解生成AB两种单质,单质A和氧气反应生成无色无味气体,通入澄清石灰水得到白色沉淀10.0g为碳酸钙,单质A为C,单质B和稀硫酸反应生成溶液C,加入过氧化氢和KSCN出现血红色溶液D说明含铁元素,证明单质B为Fe,结合元素守恒碳元素物质的量=$\frac{10.0g}{100g/mol}$=0.1mol,含碳元素质量=0.1mol×12g/mol=1.2g,铁元素物质的量=$\frac{18.0g-1.2g}{56g/mol}$=0.3mol,则铁和碳人长大了之比n(Fe):n(C)=0.3:0.1=3:1,化学式为Fe3C,
(1)上述计算得到化学式为Fe3C,
故答案为:Fe3C;
(2)溶液C为硫酸亚铁和过氧化氢在高温下反应生成硫酸铁和水,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)CH4、H2和单质B为Fe的氧化物在一定条件下反应可制备X,同时生成另一种氧化物为水,依据原子守恒配平书写得到化学方程式为:2CH4+5H2+3Fe2O3=2Fe3C+9H2O,
故答案为:2CH4+5H2+3Fe2O3=2Fe3C+9H2O;
(4)氧化还原反应中元素化合价有升高就有降低,Fe3C中碳元素化合价升高做还原剂,铁的氧化物中铁元素化合价降低做氧化剂,如Fe3C+Fe2O3=5Fe+3CO,
故答案为:Fe3C中碳元素化合价升高做还原剂,铁的氧化物中铁元素化合价降低做氧化剂,如Fe3C+Fe2O3=5Fe+3CO;
(5)向血红色溶液D中存在化学平衡Fe3++3SCN-?Fe(SCN)3,平衡逆向进行红色褪去,
A.Fe和铁离子反应平衡逆向进行,红色消失,故A正确;
B.CuCl2 溶液中溶质和平衡状态下微粒不发生反应,溶液红色不褪去,故B错误;
C.H2SO4 溶液加入对化学平衡无影响,红色不褪去,故C错误;
D.KMnO4溶液加入会氧化SCN-,使平衡逆向进行,溶液颜色褪去,故D正确;
故答案为AD.
点评 本题考查了物质组成的实验测定,物质性质、离子检验和有关定量计算等知识点,掌握基础是解题关键,题目难度中等.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案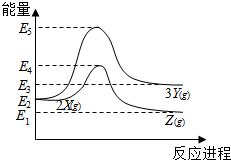
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
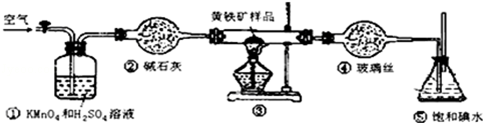
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用200mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O═2HI+H2SO4
G.吸收液用CCl4萃取
H.取20.00mL吸收液,用标准0.2000mol•L-1的NaOH溶液滴定.
试回答:
(1)写出装置③中发生反应的化学方程式4FeS2+11O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8SO2.
(2)步骤G中所用主要仪器是分液漏斗,应取上(填“上”或“下”)层溶液进行后续实验.
(3)装置①的作用是除去空气中的还原性气体,提高实验的准确率.
(4)步骤H中滴定时应选用酚酞作指示剂,可以根据滴入最后一滴NaOH溶液后,溶液变为浅红色,并在半分钟内不褪色现象来判断滴定已经达到终点.
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收.滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.98 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂D.
A.硝酸银溶液 B.氯化钙溶液 C.澄清石灰水 D.氯化钡溶液.
 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L•min) | |
| B. | 根据如图该反应的平衡常数表达式为k=c2(A)•c(B) | |
| C. | 若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
| A. | 原子序数:X>Y>Z>W | |
| B. | 离子半径:W>X>Z | |
| C. | W分别与Y、Z形成的化合物中化学键类型不同 | |
| D. | 气态氢化物的稳定性:W<Y |
| A. | 各元素在元素周期表中的族序数:W=X>Y>Z | |
| B. | 最高价氧化物对应的水化物的酸性:W>Z | |
| C. | 离子半径:X>Y>Z | |
| D. | YW3不能与NaOH溶液反应 |