题目内容
10.海水晒盐的卤水中还有氯化镁,以卤水为原料生产镁的一中工艺流程如图所示.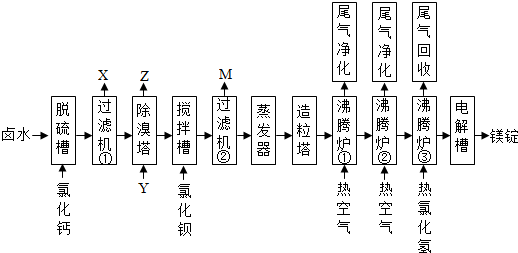
回答下列问题:
(1)脱硫槽、搅拌槽均用于脱除卤水中的SO42-(填离子符号),M的主要成分是BaSO4(填化学式).
(2)除溴塔中主要的离子方程式为Cl2+2Br-═2Cl-+Br2.
(3)沸腾炉①和②的主要作用是脱除氯化镁晶体中的部分水.沸腾炉③通入热氯化氢的主要目的是防止氯化镁晶体进一步脱水过程中发生水解.
(4)电解槽中阴极的电极反应方程式为Mg2++2e-═Mg.
(5)电解槽中阳极产物为氯气,该产物可直接用于本工艺流程中的除溴塔(除溴工段).
分析 卤水中含有Mg2+、Na+、Cl-、SO42-、Br-等离子,卤水中加入CaO在脱硫槽除去SO42-,生成CaSO4,经过滤机①得到X为CaSO4,经除溴塔,通入氯气,可除去Br-,生成Z为Br2,在搅拌槽中加入BaO,进一步除去SO42-,M的主要成分是BaSO4,经蒸发器、造粒塔,得到氯化镁晶体,再经沸腾炉①和②脱除氯化镁晶体中的部分水,沸腾炉③通入热的HCl气体,可防止发生水解,在电解槽中电解熔融的氯化镁,可得到镁锭,以此解答该题.
解答 解:卤水中含有Mg2+、Na+、Cl-、SO42-、Br-等离子,卤水中加入CaO在脱硫槽除去SO42-,生成CaSO4,经过滤机①得到X为CaSO4,经除溴塔,通入氯气,可除去Br-,生成Z为Br2,在搅拌槽中加入BaO,进一步除去SO42-,M的主要成分是BaSO4,经蒸发器、造粒塔,得到氯化镁晶体,再经沸腾炉①和②脱除氯化镁晶体中的部分水,沸腾炉③通入热的HCl气体,可防止发生水解,在电解槽中电解熔融的氯化镁,可得到镁锭,
(1)由以上分析可知脱硫槽、搅拌槽均用于脱除卤水中的 SO42-,M的主要成分是BaSO4,故答案为:SO42-;BaSO4;
(2)除溴塔中通入氯气,以除去Br-,反应的离子方程式为Cl2+2Br-═2Cl-+Br2,故答案为:Cl2+2Br-═2Cl-+Br2;
(3)经沸腾炉①和②脱除氯化镁晶体中的部分水,因氯化镁易水解生成氢氧化镁,则沸腾炉③通入热的HCl气体,可防止发生水解,
故答案为:脱除氯化镁晶体中的部分水;防止氯化镁晶体进一步脱水过程中发生水解;
(4)电解氯化镁生成镁和氯气,阴极发生还原反应,电极方程式为Mg2++2e-═Mg,故答案为:Mg2++2e-═Mg;
(5)阳极生成氯气,可用于除溴塔,除去溴,故答案为:氯气;除溴塔(除溴工段).
点评 本题考查物质的制备和分离,为2016年海南高考题,侧重于学生的分析、实验能力的考查,题目难度中等,注意根据物质的性质认真分析流程图的反应过程,正确判断各物质是解答该题的关键.

 阅读快车系列答案
阅读快车系列答案①北大研制的石墨烯弹性气凝胶(又名碳海棉)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾有效措施 | |
| C. | 绚丽缤纷彩色的烟花中添加了含钾、钠、铁、铜等金属化合物 | |
| D. | 使用该分子催化剂可将一次能源太阳能直接转化成二次能源,例如电能、氢能 |
| A. | 标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 标准状况下,22.4 L由CO和N2组成的混合气体中含有2NA个原子 | |
| C. | 一定量的浓H2SO4与0.1 mol Mg恰好完全反应,生成的SO2分子数一定为0.1NA | |
| D. | 1.6 g-NH2和1.5 g-CH3含有的电子数均为NA |
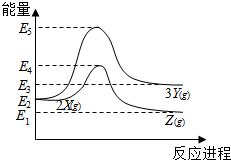
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H<0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
| A. | 乙酸甲酯 | B. | 对苯二酚 | C. | 2-甲基丙烷 | D. | 对苯二甲酸 |
 在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )
在容积为2.0L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述错误的是( )| A. | 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.067mol/(L•min) | |
| B. | 根据如图该反应的平衡常数表达式为k=c2(A)•c(B) | |
| C. | 若在第5分钟时升高温度,则该反应的正反应是吸热反应,反应的平衡常数增大,B的反应速率增大 | |
| D. | 若在第7分钟时增加D的物质的量,A的物质的量变化情况符合a曲线 |
 用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型
用二氧化氯(CLO2)、高铁酸钠 Na2FeO4摩尔质量为166g•mol-1等新型